
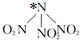
 科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3,如图,已知该分子中 N-N-N 键角都是 108.1°,下列有关N(NO2)3的说法不正确的是( )
科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3,如图,已知该分子中 N-N-N 键角都是 108.1°,下列有关N(NO2)3的说法不正确的是( )| A. | 分子中 N、O 间形成的共价键是极性键 | |
| B. | 图中加“*”N原子的杂化方式为sp3 | |
| C. | 该物质既有氧化性又有还原性 | |
| D. | 15.2g 该物质含有 6.02×1022个原子 |
分析 A.同种元素间形成非极性键,不同非金属元素间形成极性键;
B.中心原子的杂化类型为sp3,说明该分子中心原子的价层电子对个数是4,价层电子对个数=σ键个数+孤电子对个数;
C.居于最高价的只有氧化性,居于最低价的只有还原性,居于中间价的既有氧化性又有还原性;
D.根据n=$\frac{m}{M}$计算15.2 g N(NO2)3的物质的量,结合1mol,N(NO2)3分子中所含原子为10NA分析.
解答 解:A.N(NO2)3是一种共价化合物,N、O原子之间形成的化学键是极性键,故A错误;
B.图中加“*”N原子含有3个σ键和一个孤电子对,所以N原子价层电子对个数是4,则N原子采用杂化sp3,故B正确;
C.氮元素最高价为+5价,最低价为-3价,该分子中的氮元素为+3价,+3价氮既有氧化性又有还原性,故C正确;
D.N(NO2)3的相对分子质量为152,15.2 g N(NO2)3为0.1mol,该物质的分子中所含原子为1NA即6.02×1023个原子,故D正确.
故选A.
点评 本题为通过给出N(NO2)3信息,考查了极性键、N原子杂化、氧化还原、物质的构成微粒等知识点,题目难度中等,注意知识的迁移应用.


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:选择题
| A. | 单质氧化性:I2>Br2>Cl2 | B. | 热稳定性:PH3>H2S>HCl | ||
| C. | 酸性强弱:HIO4>HBrO4>HClO4 | D. | 碱性强弱:KOH>NaOH>Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
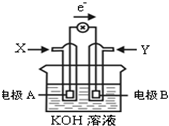 如图为某种甲醇燃料电池示意图,工作时电子流向如图所示.下列判断正确的是( )
如图为某种甲醇燃料电池示意图,工作时电子流向如图所示.下列判断正确的是( )| A. | X为氧气 | |
| B. | 电极A反应式:CH3OH-6e-+H2O=CO2+6H+ | |
| C. | B电极附近溶液pH增大 | |
| D. | 电池工作时,溶液中电子由电极B流向电极A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属Mg与稀硫酸和CO2均能反应,其反应类型相同 | |
| B. | FeCl3、Na2O2、Cu2S均可由相应单质直接化合生成 | |
| C. | SO2气体通入紫色石蕊试液中,溶液先变红后褪色 | |
| D. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18个纵行代表18个族 | |
| B. | 短周期共有32种元素 | |
| C. | 元素周期表共有七个横行代表七个周期 | |
| D. | 第IA族全部是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的醋酸溶液中加水稀释,溶液中c(OH-)减小 | |
| B. | 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) | |
| C. | 与同浓度的盐酸比较,分别加水稀释100倍,稀释后溶液中c(H+)醋酸>c(H+)盐酸 | |
| D. | 0.1 mol•L-1的醋酸与等浓度等体积的NaOH溶液反应后的溶液中:c(CH3COO-)+c(CH3COOH)=0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①②③ | C. | ②③④ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
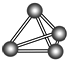 意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4气体分子.N4分子结构如图所示,下列说法不正确的是( )
意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4气体分子.N4分子结构如图所示,下列说法不正确的是( )| A. | N4与N2互为同素异形体 | B. | N4分子中只含有共价键 | ||
| C. | 1 mol N4分子所含共价键数为6NA | D. | N4发生化学反应需要破坏离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是加成产物CH3OH分子之间能形成氢键.
、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是加成产物CH3OH分子之间能形成氢键.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com