
| A、钠 | B、铝 | C、镁 | D、铁 |
| 1g |
| 23g/mol |
| 1 |
| 23 |
| 1g |
| 27g/mol |
| 1 |
| 9 |
| 1g |
| 24g/mol |
| 1 |
| 12 |
| 1g |
| 56g/mol |
| 1 |
| 28 |


科目:高中化学 来源: 题型:
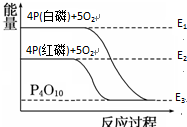
| A、白磷比红磷稳定 |
| B、白磷燃烧是吸热反应 |
| C、红磷转变为白磷是吸热反应 |
| D、红磷燃烧的热化学方程式:4P(s)+5O2(g)=P4O10(s)△H=(E2-E3)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时,Li作负极 |
| B、电解质溶液为非水溶液体系 |
| C、充电时铁元素发生还原反应 |
| D、若用该电池电解饱和食盐水(电解池电极均为惰性电极)当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为1.4 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、原子半径X>Y>Z>V>W |
| B、最高价氧化物的水化物的碱性:Z>Y>W |
| C、W的单质只有还原性,没有氧化性 |
| D、以Y、Z作为电极,硫酸作为电解质溶液的原电池中,Y做负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 总压强p 100kPa | 5 | 5.6 | 6.4 | 6.8 | 7 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、t1 |
| B、t2 |
| C、t3 |
| D、t4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com