
 一种碳纳米管能够吸附氢气,可做二次电池(如图所示)的碳电极.该电池的电解质为6mol/LKOH溶液,下列说法正确的是( )
一种碳纳米管能够吸附氢气,可做二次电池(如图所示)的碳电极.该电池的电解质为6mol/LKOH溶液,下列说法正确的是( )| A. | 放电时镍电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH- | |
| B. | 放电时OH-移向镍电极 | |
| C. | 充电时碳电极反应为H2-2e-+2OH-=2H2O | |
| D. | 充电时将碳电极与电源的正极相连 |
分析 根据图片中电子流向知,放电时,石墨电极是负极,电极反应式为H2+2OH--2e-=2H2O,正极反应式为NiO(OH)+H2O+e-═Ni(OH)2+OH-,充电时阴阳极与放电时负极、正极反应式正好相反,以此解答该题.
解答 解:A.放电时镍电极是正极,正极上NiO(OH)得电子发生还原反应生成Ni(OH)2,电极反应式为NiO(OH)+H2O+e-═Ni(OH)2+OH-,故A正确;
B.放电时阴离子向负极移动,即向碳电极移动,故B错误;
C.放电时,电解质溶液呈碱性,负极上氢气失电子和氢氧根离子反应生成水,电极反应式为H2+2OH--2e-=2H2O,故C错误;
D.充电时,C电极作阴极,所以应该与电源负极相连,故D错误.
故选A.
点评 本题考查化学电源新型电池,为高考高频点,明确各个电极上发生的反应是解本题关键,会结合电解质溶液酸碱性书写电极反应式,知道放电时和充电时电极反应式关系,题目难度中等.


科目:高中化学 来源: 题型:解答题
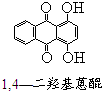 芳香族化合物A(C8H6O4)能与NaHCO3溶液反应生成CO2.由A与对二氯苯(
芳香族化合物A(C8H6O4)能与NaHCO3溶液反应生成CO2.由A与对二氯苯( )为原料经多步反应可合成1,4-二羟基蒽醌(结构如图所示).
)为原料经多步反应可合成1,4-二羟基蒽醌(结构如图所示). .
.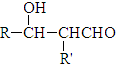 $\stackrel{△}{→}$
$\stackrel{△}{→}$
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol苯分子中含有双键数 | |
| B. | 1mol CaC2固体中含阴离子总数 | |
| C. | 1L 1mol/L CH3COOH溶液中所含分子总数 | |
| D. | 1mol Cl2参加化学反应获得的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用聚二氧化碳可降解塑料,能减少白色污染 | |
| B. | 通常所说的三大有机合成材料是指塑料、合成纤维、合成橡胶 | |
| C. | 实验“煤改气”“煤改电”等清洁燃料改造工程,有利于保护环境 | |
| D. | 夏天雷雨过后感觉到空气清新是因为空气中产生了少量的二氧化氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| B. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 | |
| C. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 | |
| D. | 施肥时,草木灰(有效成分为K2CO3)和NH4Cl混合使用,会产生氨气降低肥效 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 防止“地沟油”重上餐桌的方法之一是将其制成生物柴油,在汽油中添加20%的生物柴油可减少50%的CO2、70%的SO2的排放,空气毒性可降低90% | |
| B. | 北京市600个居住小区率先进行垃圾分类试点,以促进垃圾的综合利用 | |
| C. | 减少CO2的方法有可将CO2制成干冰用于人工降雨、用石灰水吸收CO2、将CO2制成甲醇、种植树木吸收CO2等 | |
| D. | 限制化学发展,关停化工企业,消除污染源头 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硫酸铝溶液中滴加过量的氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | 金属铜与浓硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 实验室制备氢氧化铁胶体:Fe3++3H2O═Fe(OH)3(胶体)+3H+ | |
| D. | 向苯酚钠溶液中通入少量的二氧化碳气体:2C6H5ONa+CO2+H2O═2C6H6O+Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应:2SO2(g)+O2(g)═2SO3(g),下列说法中,正确的是C.
(1)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应:2SO2(g)+O2(g)═2SO3(g),下列说法中,正确的是C.| 相关反应 | 反应热 | 平衡常数K |
| FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| $\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$Fe(s)+H2S(g) | △H2 | K2 |
| FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①④ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com