
| A.C2H4在氧气中充分燃烧生成的CO2与H2O的物质的量之比 |
| B.K2S溶液中c(K+)与c(S2-)之比 |
| C.Na2O2晶体中阳离子与阴离子的物质的量之比 |
| D.16O原子的中子数和质量数之比 |
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源:不详 题型:推断题
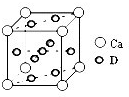
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 号元素的核外电子排布式_______________________________________;
号元素的核外电子排布式_______________________________________; 第一电离能的大小关系为________________(用元素符号表示)
第一电离能的大小关系为________________(用元素符号表示)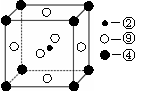
| A.分子中含有氢键 | B.易发生加成反应 |
| C.含有4个σ键和1个π键 | D.分子中所有原子处于同一个平面 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验事实 | 理论解释 |
| A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子为非极性分子 |
| C | 金刚石的熔点低于石墨 | 石墨熔融时除了破坏共价键,还需破坏范德华力 |
| D | HF的沸点高于HCl | H-F的键能大于H-Cl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
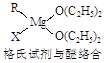
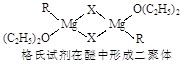
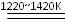 Ti+2MgCl2
Ti+2MgCl2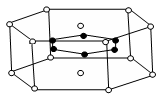
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1个甘氨酸分子中存在10对共用电子 |
| B.PCl3和了BCl3分子中所有原子的最外层都达到8电子稳定结构 |
| C.维勒用无机物合成了尿素,突破了无机物与有机物的界限 |
| D.熔点由高到低的顺序是:金刚石>碳化硅>晶体硅 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 序号 | 元素 | 结构及性质 |
| ① | A | A在第三周期中简单离子半径最小 |
| ② | B | B原子最外层电子数是内层电子数的1/5 |
| ③ | C | C是常用化肥的主要元素,单质常温下呈气态 |
| ④ | D | 通常情况下,D没有正化合价,A、B、C都能与D形成化合物 |
| ⑤ | E | E在周期表中可以排在IA族,也可以排在ⅦA族 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2O是一种非常稳定的化合物,这是由于氢键所致 |
| B.稀有气体形成的晶体属于分子晶体 |
| C.干冰升华时,分子内共价键会发生断裂 |
| D.金属晶体的熔点普遍都很高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com