
【题目】以下措施都能使海洋钢质钻台增强抗腐蚀能力,其中属于“牺牲阳极的阴极保护法”的是( )
A.对钢材“发蓝”(钝化)B.选用铬铁合金
C.外接电源负极D.连接锌块
科目:高中化学 来源: 题型:
【题目】某同学研究浓度对化学平衡的影响,下列说法正确的是( )
已知: | |
步骤: | 现象: |
A.该反应是一个氧化还原反应
B.待试管b中溶液颜色不变的目的是使Cr2O72﹣完全反应
C.该实验不能证明减小生成物浓度,平衡正向移动
D.试管c中的现象说明影响平衡的主要因素是温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2SO4溶液和KOH溶液反应时有热量放出,已知反应物的总能量为E1,生成物的总能量为E2。试回答下列问题:
(1)用离子方程式表示中和反应的实质 。
(2)判断E1和E2的大小关系:E1 E2。
(3)已知H+(aq)+OH(aq)![]() H2O(l) ΔH=57.3 kJ/mol,计算下列中和反应中放出的热量。
H2O(l) ΔH=57.3 kJ/mol,计算下列中和反应中放出的热量。
①用20 g NaOH配成稀溶液与足量稀盐酸反应,能放出 kJ的热量。
②用0.1 mol Ba(OH)2配成稀溶液跟足量稀硝酸反应,能放出 kJ的热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图表示在某溶液中滴加Ba(OH)2 溶液时,沉淀的物质的量随Ba(OH)2 的物质的量的变化关系。该溶液的成分可能是
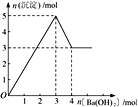
A. MgSO4 B. Al2 (SO4 )3 C. Fe2 (SO4 )3 D. NaAlO2
【答案】B
【解析】A、氢氧化镁不溶于氢氧化钡溶液,沉淀量达最大后,再加氢氧化钡溶液,沉淀量不变,A错误;B、由图可知溶解氢氧化铝需要1mol氢氧化钡,由Al(OH)3+OH-===AlO2-+2H2O可知沉淀中Al(OH)3为2mol,故Al2(SO4)3为1mol,加入3mol氢氧化钡,可以生成硫酸钡3mol,n(Al3+):n(OH-)=2mol:6mol=1:3,发生反应Al3++3OH-===Al(OH)3↓,可以得到2molAl(OH)3,沉淀为3mol+2mol=5mol,B正确;C、硫酸铁与氢氧化钡溶液反应生成氢氧化铁,氢氧化铁不溶于氢氧化钡,则沉淀量达最大后,再加氢氧化钡溶液,沉淀的量不变,与图象不一致,C错误;D、偏铝酸钠与氢氧化钡不反应,不能产生沉淀,D错误;答案选B。
点睛:本题以图象为载体考查镁铝化合物的性质,明确发生的化学反应是解答的关键,反应发生的先后顺序是学生解答中的难点,注意图象比例关系,注意氢氧化铝两性特点。
【题型】单选题
【结束】
15
【题目】如图所示是向MgCl2和AlCl3的混合溶液中加入NaOH溶液和盐酸时沉淀的物质的量y mol与加入NaOH溶液和盐酸的体积x mL的关系图,根据图示判断,下列结论中不正确的是
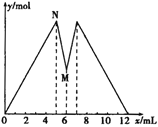
A. N点时溶液中的溶质只有NaCl
B. 原混合溶液中c (MgCl2)∶c (AlCl3)=1∶2
C. c (NaOH)=c (HCl)
D. M点之前加入的是NaOH溶液,M点之后加入的是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物不能由CH2=CH2通过加成反应制取的是( )
A. CH3CH2ClB. CH2Cl—CH2Cl
C. CH3—CH2OHD. CH3—COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列几个离子反应:
① Cr2O![]() +14H++6Cl-===2Cr3++3Cl2↑+7H2O
+14H++6Cl-===2Cr3++3Cl2↑+7H2O
② 2Fe2++Br2===2Fe3++2Br- ③ 2Br-+Cl2=== Br2+2Cl-
④ 2Fe3++SO2+2H2O===2Fe2++SO![]() +4H+
+4H+
下列有关性质的比较中正确的是( )。
A. 氧化性:Cr2O![]() >Cl2>Fe3+ B. 氧化性:Cl2>Br2>Cr2O
>Cl2>Fe3+ B. 氧化性:Cl2>Br2>Cr2O![]()
C. 还原性:SO2<Fe2+<Br- D. 还原性:Cl->Cr3+>Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1000ml某无色待测液中除含有0.2molL﹣1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl﹣、CO32﹣、HCO3﹣、SO42﹣ |
现进行如下实验操作(所加试剂均过量):(已知:NH4++OH﹣(浓)=NH3↑+H2O)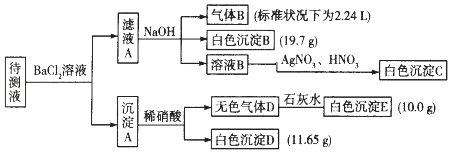
(1)原溶液中肯定存在的离子是(除Na+) , 肯定不存在的离子是 .
(2)写出生成白色沉淀B的离子方程式: . 写出沉淀A溶于稀硝酸的离子方程式: .
(3)将滤液A和沉淀A分开的操作是过滤,洗涤.洗涤的操作是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com