
| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
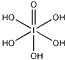 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4(填“>”、“<”或“=”)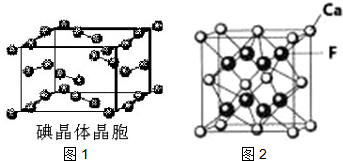
分析 (1)根据基态原子核外电子排布式中最后填入电子名称确定区域名称;
(2)根据氢键分析解答;
(3)元素的第一电离能越大,元素失电子能力越弱,得电子能力越强,元素的第一电离能越小,元素失电子能力越强,得电子能力越弱,则越容易形成阳离子;
(4)根据含氧酸中,酸的元数取决于羟基氢的个数,含非羟基氧原子个数越多,酸性越强;
(5)根据价层电子对互斥理论来确定其杂化方式,价层电子对个数=σ键个数+孤电子对个数;等电子体是具有相同的价电子数和相同原子数的微粒;
(6)碘为分子晶体,晶胞中占据顶点和面心,据此分析;
(7)利用均摊法确定该立方体中含有的离子,根据ρV=nM计算相对分子质量;
解答 解:(1)根据构造原理知,卤族元素最后填入的电子为p电子,所以卤族元素位于元素周期表的p区,故答案为:p;
(2)HF分子之间存在氢键,使氢氟酸分子缔合,故答案为:氢键;
(3)卤族元素包含:F、Cl、Br、I、At元素,元素的第一电离能越小,元素失电子能力越强,得电子能力越弱,则越容易形成阳离子,根据表中数据知,卤族元素中第一电离能最小的是I元素,则碘元素易失电子生成简单阳离子;
故答案为:I;
(4)H5IO6(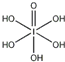 )中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有2个羟基氢,含非羟基氧原子2个,则酸性:H5IO6<HIO4,
)中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有2个羟基氢,含非羟基氧原子2个,则酸性:H5IO6<HIO4,
故答案为:<;
(5)ClO2-中心氯原子的价层电子对数n=2+$\frac{7+1-2×2}{2}$=4,属于sp3杂化;等电子体具有相同的电子数目和原子数目的微粒,所以与ClO3-互为等电子体的分子为NCl3等;
故答案为:sp3;NCl3;
(6)A.碘分子的排列有2种不同的取向,在顶点和面心不同,2种取向不同的碘分子以4配位数交替配位形成层结构,故A正确;
B.用均摊法可知平均每个晶胞中有4个碘分子,即有8个碘原子,故B错误
C.碘晶体为无限延伸的空间结构,构成微粒为分子,是分子晶体,故C错误;
D.碘晶体中的碘原子间存在I-I非极性键,且晶体中分子之间存在范德华力,故D错误;
故答案为:A;
(7)该立方体中钙离子位于顶点,数目为:8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氟离子位于体内,数目为8,则晶胞摩尔质量为4M,相邻且最近的两个Ca2+的核间距为a cm,晶胞边长为$\frac{\sqrt{2}}{2}$acm,ρ•($\frac{\sqrt{2}}{2}$a)3=$\frac{4M}{N{\;}_{A}}$,M=$\frac{\sqrt{2}}{2}$a3ρNA;
故答案为:$\frac{\sqrt{2}}{2}$a3ρNA.
点评 本题考查物质结构与性质,综合性强,涉及元素周期表、核外电子排布、分子结构与性质、电离能、晶体结构与性质、杂化轨道、等电子体、晶胞计算等,侧重对主干知识的考查,需要学生熟练掌握基础知识,题目难度中等.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2通入高锰酸钾酸性溶液中,红色褪去 | |
| B. | SO2通入品红溶液中,红色褪去 | |
| C. | SO2通入溴水溶液中,红棕色褪去 | |
| D. | SO2通入氢氧化钠与酚酞的混合溶液中,红色褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | 2H2O2═2H2O+O2↑ | D. | 2Al+2NaOH+2H2O═2NaAlO2+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HS-+H2O?H3O++S2- | B. | HS-+H2O?H2S+OH- | ||
| C. | HS-+H2O+=H2S↑+H2O | D. | CO32-+H2O+CO2=2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:3 | B. | 23:28:9 | C. | 6:3:2 | D. | 28:23:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在电解冶炼铝的过程中加入冰晶石,可起到降低Al2O3熔点的作用.冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3═2Na3AlF6+3CO2↑+9H2O.根据题意完成下列填空:
在电解冶炼铝的过程中加入冰晶石,可起到降低Al2O3熔点的作用.冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3═2Na3AlF6+3CO2↑+9H2O.根据题意完成下列填空: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com