
Na2SO3在空气中易被氧化而变质。某同学为证明Na2SO3有还原性,从一瓶长期存放的Na2SO3固体中取出少量溶于水,滴入一定量的烧碱溶液和少许溴水,振荡后溶液变为无色。
(1)在碱性溶液中,Br2与Na2SO3反应的离子方程式:__________________________________________________________。
(2)反应后,溶液含有SO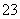 、SO
、SO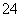 、Br-、OH-等阴离子,下表是某同学鉴定其中SO
、Br-、OH-等阴离子,下表是某同学鉴定其中SO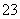 、SO
、SO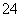 和Br-的实验报告,请完成未填完的部分。
和Br-的实验报告,请完成未填完的部分。
限选试剂:2 mol·L-1盐酸;1 mol·L-1H2SO4溶液;1 mol·L-1BaCl2溶液;1 mol·L-1Ba(NO3)2溶液;CCl4、新制饱和氯水、品红溶液。
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 取少量待测液于试管中,加入过量的2 mol·L-1盐酸,再滴加适量1 mol·L-1BaCl2溶液 | 有白色沉淀生成,证明待测液中含SO |
| 步骤② | ||
| 步骤③ |
(3)为测定上述样品的纯度,该同学取10.0 g试样,配成250 mL溶液,取25.00 mL所配溶液,用0.10 mol·L-1的酸性KMnO4溶液滴定至终点。离子反应为2MnO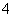 +5SO
+5SO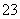 +6H+===2Mn2++5SO
+6H+===2Mn2++5SO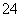 +3H2O,重复操作三次,每次消耗0.10 mol·L-1 KMnO4溶液的体积分别为20.02 mL、20.00 mL和19.98 mL。
+3H2O,重复操作三次,每次消耗0.10 mol·L-1 KMnO4溶液的体积分别为20.02 mL、20.00 mL和19.98 mL。
①该试样中Na2SO3的质量分数为________(结果保留3位有效数字);
②操作时,若未用0.10 mol·L-1的酸性KMnO4溶液润洗滴定管,会导致测定结果________(填“偏高”、“偏低”或“没有影响”)。
解析 (1)溶液褪色说明SO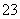 与Br2发生了氧化还原反应,结合氧化还原反应规律知氧化产物、还原产物一定为SO
与Br2发生了氧化还原反应,结合氧化还原反应规律知氧化产物、还原产物一定为SO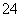 、Br-,再结合电荷守恒及介质为碱性可知还有OH-参与反应,同时有H2O生成,由此可写出与Na2SO3溶液反应的离子方程式。(2)结合有关离子的性质知需加入盐酸,排除SO
、Br-,再结合电荷守恒及介质为碱性可知还有OH-参与反应,同时有H2O生成,由此可写出与Na2SO3溶液反应的离子方程式。(2)结合有关离子的性质知需加入盐酸,排除SO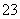 干扰,利用BaCl2溶液检验SO
干扰,利用BaCl2溶液检验SO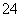 ;然后另取少量待测溶液加入足量盐酸排除SO
;然后另取少量待测溶液加入足量盐酸排除SO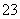 ,然后选用氯水(或氯水、CCl4),通过观察溶液颜色变化(或萃取后观察CCl4层颜色变化)来判断Br-的存在;最后另取少量待测溶液,加入足量盐酸,再滴加品红溶液,通过品红溶液褪色(SO
,然后选用氯水(或氯水、CCl4),通过观察溶液颜色变化(或萃取后观察CCl4层颜色变化)来判断Br-的存在;最后另取少量待测溶液,加入足量盐酸,再滴加品红溶液,通过品红溶液褪色(SO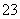 与H+反应产生H2SO3导致)来判断SO
与H+反应产生H2SO3导致)来判断SO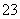 的存在。(3)①三次操作消耗KMnO4溶液的平均值为20.00 mL,利用方程式可知10.0 g样品中含有m(Na2SO3)=0.10 mol·L-1×0.020 L×
的存在。(3)①三次操作消耗KMnO4溶液的平均值为20.00 mL,利用方程式可知10.0 g样品中含有m(Na2SO3)=0.10 mol·L-1×0.020 L×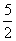 ×126 g·mol-1×250 mL/25.00 mL=6.30 g,故其质量分数为6.30 g÷10.0 g×100%=63.0%。②若未用KMnO4溶液润洗滴定管,则引起KMnO4溶液浓度变小,导致消耗体积变大,因此所求Na2SO3质量偏大,故使测定结果偏高。
×126 g·mol-1×250 mL/25.00 mL=6.30 g,故其质量分数为6.30 g÷10.0 g×100%=63.0%。②若未用KMnO4溶液润洗滴定管,则引起KMnO4溶液浓度变小,导致消耗体积变大,因此所求Na2SO3质量偏大,故使测定结果偏高。
答案 (1)SO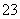 +Br2+2OH-===H2O+SO
+Br2+2OH-===H2O+SO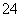 +2Br-
+2Br-
(2)
| 实验操作 | 预期现象与结论 | |
| 步骤② | 方法1:取少量步骤①中上层清液于试管中,加入少量氯水,观察溶液的颜色(若再加入CCl4,振荡,静置观察颜色也可) | 溶液呈橙黄色,证明待测液中含有Br-(下层液体呈橙红色,证明待测液中含Br-) |
| 方法2:另取少量待测液于试管中,加入足量的2 mol·L-1盐酸直到不产生气泡为止,再加入少量氯水,观察溶液的颜色(若再加入四氯化碳,振荡,静置后观察颜色也可) | 溶液呈橙黄色,证明待测液中含Br-(下层液体呈橙红色,证明待测液中含Br-) | |
| 步骤③ | 方法1:取出步骤①中适量上层清液于试管中,滴入1~2滴品红溶液,观察溶液的颜色 | 红色褪去,则存在SO |
| 方法2:另取少量待测液于试管中,加入过量2 mol·L-1盐酸,再滴入1~2滴品红溶液,观察溶液的颜色 | 红色褪去,则存在SO |


科目:高中化学 来源: 题型:
下列常见实验的现象或表述正确的是( )。
A.向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加入几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+
B.为检验红砖中铁的价态,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴,溶液变为红色,说明红砖中只有三氧化二铁
C.制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁
D.将(NH4)2Fe(SO4)2·6H2O试样溶于稀硝酸中,滴加KSCN溶液,出现血红色,说明检验前该试样已变质
查看答案和解析>>
科目:高中化学 来源: 题型:
在合成氨时,要使氨的产率增大,又要使化学反应速率增大,可以采取的措施有( )
①增大体积使压强减小 ②减小体积使压强增大 ③升高温度 ④降低温度 ⑤恒温恒容,再充入等量的N2和H2
⑥恒温恒压,再充入等量的N2和H2 ⑦及时分离产生的NH3 ⑧使用正催化剂
A.②④⑤⑦ B.②③④⑤⑦⑧ C.②⑤ D.②③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
如右图所示,A为直流电源,B为浸透饱和氯化钠溶液和酚酞溶液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
(1)电源A上的a为________极。
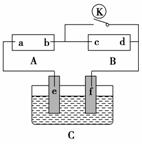
(2)滤纸B上发生的总化学反应方程式为__________________________________________________________
__________________________________________________________。
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为__________________________,电极f上发生的反应为________________________,槽中盛放的电镀液可以是________或________(只要求填两种电解质溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硅广泛存在于自然界中,在日常生活、生产、科研及新型材料等方面有着重要的用途。a~e是对①~⑤反应中SiO2所表现的化学性质或作用所作的判断,其中正确的是( )
①SiO2+2NaOH===Na2SiO3+H2O
②SiO2+2C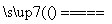 Si+2CO↑
Si+2CO↑
③SiO2+4HF===SiF4↑+2H2O
④Na2CO3+SiO2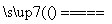 Na2SiO3+CO2↑
Na2SiO3+CO2↑
⑤SiO2+3C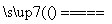 SiC+2CO↑
SiC+2CO↑
a.反应①中SiO2作为玻璃的主要成分被消耗,用于雕刻玻璃
b.反应②中SiO2表现为氧化性
c.反应③中SiO2表现了酸性氧化物的通性
d.反应④中SiO2将挥发性的酸酐从其盐中置换出来
e.反应⑤中SiO2未参加氧化还原反应
A.ace B.bde
C.cde D.dab
查看答案和解析>>
科目:高中化学 来源: 题型:
软锰矿是制备二氧化锰的原料,软锰矿中含有二氧化硅、氧化铜、氧化铁、氧化铝、氧化锌等杂质。工业上以软锰矿为原料制备高纯二氧化锰的工艺流程图如下:
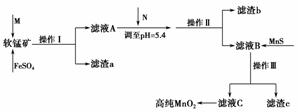
(1)酸性条件下,FeSO4将MnO2还原为MnSO4,那么加入的酸M为________,该反应的离子方程式为______________________________。
(2)制备二氧化锰工艺流程中涉及的阳离子以氢氧化物的形式完全沉淀时溶液的pH如下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 | 10.4 |
由流程图信息和表格中数据可知滤渣b的主要成分是________(填化学式)。调节溶液pH=5.4需加入试剂N,N可以是________。
a.CO2 b.稀硫酸 c.NH3 d.氨水
(3)部分硫化物的溶度积常数(Ksp)如下表:
| 硫化物 | CuS | ZnS | MnS | FeS |
| Ksp | 6.3×10-36 | 2.9×10-25 | 2.5×10-13 | 6.3×10-18 |
由表格中的数据推知流程图中向滤液B中加入MnS的作用是__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,甲、乙两烧杯均盛有5 mL pH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4。关于甲、乙两烧杯中溶液的描述正确的是(双选)( )
A.溶液的体积10V甲≤V乙
B.水电离出的OH-浓度:10c(OH-)甲≤c(OH-)乙
C.若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙
D.若分别与5 mL pH=11的NaOH溶液反应,所得溶液的pH :甲≤乙
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,0.1 mol·L-1的硫化钠溶液和0.1 mol·L-1的碳酸钠溶液,碱性更强的是__________,其原因是___________________________________________________。
已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15
H2CO3:Ki1=4.3×10-7 Ki2=5.6×10-11
查看答案和解析>>
科目:高中化学 来源: 题型:
化学在生产和生活中有着重要的应用。下列说法正确的是(双选)( )
A.“雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮的氧化物无关
B.“辽宁舰”上用于舰载机降落拦阻索的特种钢缆属于特种金属材料
C.白酒中混有少量塑化剂,可通过过滤除去
D.能够改善食品的色、香、味,并有防腐、保鲜作用的食品添加剂应限量使用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com