
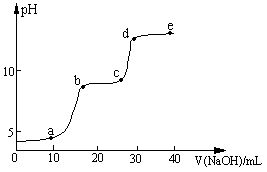
| 较大量存在的含金属元素的离子 | 检验方法 |
| | |
| | |
| | |
| 较大量存在的含金属元素的离子 | 检验方法 |
| Na+ | 用洁净的铂丝蘸取少量待测液在酒精灯火焰上灼烧,若火焰呈黄色,表明存在Na+ |
| [Al(OH)4]- | 取少量待测液于试管中,滴加盐酸,产生白色沉淀,盐酸过量时,沉淀又溶解 |


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源:不详 题型:填空题
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| A.c(Na+) = 2c(CO32-) | B.c(Na+) > c(CO32-) > c(HCO3-) |
| C.c(OH-) > c(HCO3-) > c(H+) | D.c(OH-) - c(H+)=c(HCO3-) + 2c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
| B.工业上金属钠是通过氯碱工业制取 |
| C.从第③步到第⑤步的目的是为了浓缩 |
| D.在第③④⑤步中溴元素均被氧化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| 物质 | 熔点/0C | 沸点/0C |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若三支试管出现沉淀时,则后加入的是AgNO3 |
| B.全部没有什么现象变化时,则后加入的是NH4NO3 |
| C.一支试管出现气体,另两支试管出现沉淀时,最后加入的盐酸 |
| D.若只有两支试管出现沉淀时,则后加入的是BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.苯 (苯酚)—— 加入适量浓溴水,过滤 |
| B.(NO2)——通过水洗、干燥后,用向下排空气法收集 |
| C.乙烷 (乙烯)——让气体通过盛有酸性高锰酸钾溶液的洗气瓶 |
| D.乙醇 (乙酸)——加足量CaO固体,蒸馏 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.④①②③ | B.①④③② | C.①③④② | D.④②①③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com