
分析 硫与浓硫酸发生归中反应生成二氧化硫,二氧化硫具有漂白性,能够使品红溶液褪色,依据氧化还原反应得失电子守恒结合原子个数守恒配平方程式,据此解答.
解答 解:(1)硫与浓硫酸发生归中反应生成二氧化硫,二氧化硫具有漂白性,能够使品红溶液褪色,所以该气体为二氧化硫,
故答案为:二氧化硫;
(2)硫与浓硫酸反应生成二氧化硫和水,硫元素从0价升高为+4价,浓硫酸中+6价硫降为+4价,依据得失电子守恒,硫单质系数为1,硫酸系数为2,二氧化硫系数为3,依据原子个数守恒方程式:S+2H2SO4(浓浓)=3SO2↑+2H20;
故答案为:S+2H2SO4(浓浓)=3SO2↑+2H20.
点评 本题考查了二氧化硫的性质及氧化还原方程式书写,明确二氧化硫的漂白性及氧化还原反应得失电子守恒规律是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: |
| I1=738kJ•mol-1 I2=1451kJ•mol-1 I3=7733kJ•mol-1 I4=10540kJ•mol-1 |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中未成对电子最多的元素 |
| G的3d能级只含有2对成对电子 |
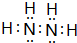 .
. 该同学所画的电子排布图违背了泡利原理.
该同学所画的电子排布图违背了泡利原理.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水合肼(N2H4•H2O)为无色透明的油状液体,沸点为118.5℃,熔点为-40℃.具有强碱性,在空气中可吸收CO2,产生烟雾.水合肼是一种强还原剂,能与卤素单质、HNO3、KMnO4等激烈反应.水合肼可用含NaOH的NaClO溶液氧化尿索[CO(NH2)2]溶液制得.实验室模拟水合肼的制备装置如图所示(夹持及加热装置已省略).请回答下列问题:
水合肼(N2H4•H2O)为无色透明的油状液体,沸点为118.5℃,熔点为-40℃.具有强碱性,在空气中可吸收CO2,产生烟雾.水合肼是一种强还原剂,能与卤素单质、HNO3、KMnO4等激烈反应.水合肼可用含NaOH的NaClO溶液氧化尿索[CO(NH2)2]溶液制得.实验室模拟水合肼的制备装置如图所示(夹持及加热装置已省略).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
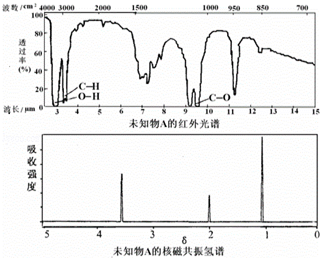
| A. | 由红光外谱可知,该有机物中有三种不同的化学键 | |
| B. | 由核磁共振氢谱可知,该有机物分子中有两种不同化学环境的氢原子 | |
| C. | 仅由核磁共振氢谱即可得知其分子中的氢原子总数 | |
| D. | 若A的化学式为C2H6O,则其结构简式为CH3-O-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
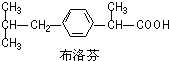
| A. | 布洛芬的分子式C13H18O2 | |
| B. | 布洛芬与苯乙酸(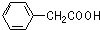 )是同系物 )是同系物 | |
| C. | 布洛芬苯环上的一氯代物有2种 | |
| D. | 常温条件下,1 mol布洛芬完全与金属钠反应可得到1 mol H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com