

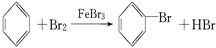
 ,
, ;
;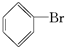 与Br2;NaOH溶液(或水);分液漏斗;
与Br2;NaOH溶液(或水);分液漏斗;

科目:高中化学 来源: 题型:
| A、醋酸和氢氧化钠溶液反应 |
| B、氢氧化镁和盐酸反应 |
| C、澄清石灰水和硝酸反应 |
| D、氢氧化钡和稀硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
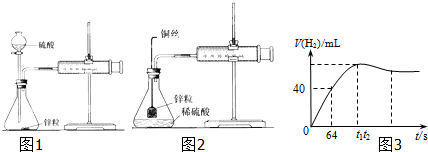
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 实验步骤 | 预期现象与结论 |
| 步骤I:取少量样品于一支试管中,向其中加入适量 ,塞上带导管的单孔塞,将导管另一端插入盛有足量 的试管中 | |
| 步骤II: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al-Mg合金焊接过程中使用的保护气为N2 |
| B、工业上可采用电解熔融NaCl的方法制备金属钠 |
| C、将0.5molN2和1.5molH2充入一密闭容器中充分反应,放出热量19.6KJ,则该热化学方程式为N2(g)+3 H2(g)?2NH3(g)△H=-39.2 KJ?mol-1 |
| D、已知:2H2(g)+O2(g)?2H2O(g)△H=-486 KJ?mol-1,则H2的燃烧热△H为-243 KJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
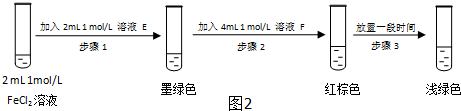
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐溶液都是中性的 |
| B、盐溶液的酸碱性与盐的类型无关 |
| C、NaHCO3溶液显酸性 |
| D、碳酸钠溶液显碱性,溶液中c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com