
【题目】CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol1
C(s)+![]() O2(g)===CO(g) ΔH=-111 kJ·mol1
O2(g)===CO(g) ΔH=-111 kJ·mol1
①该催化重整反应的ΔH=____ kJ·mol1。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
②某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为______mol2·L2。下列可判断该反应达到平衡的是_________(填标号)。
A.单位时间内生成n mol的CH4,同时生成n mol的H2 B.v(CH4):v(CO)=1:2
C.容器中混合气体的密度不再发生变化 D.容器中的压强保持不变
(2)CO2可以被(NH4)2CO3溶液捕获,反应为(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH。为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图1,则ΔH______(填“>”、“=”或“<”)0。
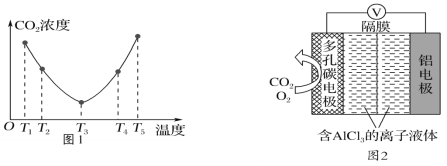
(3)O2辅助的Al-CO2电池工作原理如图2所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的负极反应式:________________________________。
电池的正极反应式:6O2+6e-=6O;6CO2+6O=3C2O42-+6O2
反应过程中O2的作用是_________________。
(4)CO2可以被NaOH溶液捕获。若所得溶液c(HCO3-):c(CO32-) = 2∶1,溶液pH=________。(室温下,H2CO3的K1=4×10-7;K2=5×10-11)
【答案】+247或247 A ![]() 或0.33 D < Al-3e-=Al3+(或2Al-6e-=2Al3+) 催化剂 10
或0.33 D < Al-3e-=Al3+(或2Al-6e-=2Al3+) 催化剂 10
【解析】
(1)①已知:a.C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol1
b.C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol1
c.C(s)+![]() O2(g)=CO(g) ΔH=-111 kJ·mol1
O2(g)=CO(g) ΔH=-111 kJ·mol1
将方程式2c-a-b得CH4(g)+CO2(g)═2CO(g)+2H2(g),△H=2×(-111kJ·mol-1)-(-75kJ·mol-1)-(-394kJ·mol-1)=+247kJ·mol-1;
要提高CH4平衡转化率应该使平衡正向移动,但是不能通过增大甲烷浓度实现,该反应的正反应是一个反应前后气体体积增加的吸热反应,升高温度、减小压强能使平衡正向移动,增大甲烷转化率,故选A;
②达到平衡时CO2的转化率是50%,根据方程式知,参加反应的n(CO2)=n(CH4)=1mol×50%=0.5mol,生成的n(CO)=n(H2)=1mol,
CH4(g)+CO2(g)═2CO(g)+2H2(g),
开始(mol·L-1) 1 0.5 0 0
反应(mol·L-1) 0.25 0.25 0.5 0.5
平衡(mol·L-1) 0.75 0.25 0.5 0.5
化学平衡常数K=![]() =
=![]() =1/3;
=1/3;
A.单位时间内生成n mol的CH4,同时生成n mol的H2 ,正逆反应速率不相等,反应未达到平衡,故A错误;
B.v(CH4):v(CO)=1:2,无法确定正逆速率是否相等,故B错误;
C.反应物和生成物均为气体且为恒容容器,容器中气体的密度始终不变,则容器中混合气体的密度不再发生变化,不能用于判断是否达到平衡状态,故C错误;
D.反应前后体积不等,容器中的压强保持不变,能用于判断是否达到平衡状态,故D正确;
故选D。
(2)从c(CO2)的变化趋势可知,开始时减小是没达到平衡,拐点是平衡点,拐点后随温度的升高c(CO2)增大,说明平衡向逆向移动,正反应为放热反应,则△H<0;
(3)该原电池中Al作负极,失电子生成铝离子,电极反应式为Al-3e-=Al3+;在正极的反应式中,氧气在第一个反应中作反应物、在第二个反应中作生成物,所以氧气在反应中作催化剂;
(4)K2=c(CO32-)c(H+)/c(HCO3-)=5×10-11,且所得溶液c(HCO3-):c(CO32-)=2:1,c(H+)=K2·c(HCO3-)/c(CO32-)=5×10-11×2=1×10-10,pH=10。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】萜品油烯(D)可用作香料的原料,它可由A合成得到如下所示,下列说法正确的是 ( )

A. 有机物B的分子式为C11H19O3
B. 有机物D分子中所有碳原子一定共面
C. 1 mol有机物A中含有1.204×1024个双键
D. 有机物C的同分异构体中不可能有芳香化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 64 g SO2含有氧原子数为1NA
B. 物质的量浓度为0.5 mol·L-1的MgCl2溶液,含有Cl-数为1 NA
C. 标准状况下,22.4 L H2O的分子数为1NA
D. 常温常压下,14 g N2含有分子数为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mX(g)![]() nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示,下列说法错误的是( )
nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示,下列说法错误的是( )
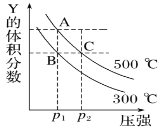
A. 该反应的ΔH>0
B. m<n+p
C. B、C两点化学平衡常数:KB>KC
D. A、C两点的反应速率v(A)<v(C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
|
|
A.4.03米大口径碳化硅反射镜 | B.2022年冬奥会聚氨酯速滑服 | C.能屏蔽电磁波的碳包覆银纳米线 | D.“玉兔二号”钛合金筛网轮 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,容积为2 L的密闭容器中,将2 mol L气体和3 mol M气体混合,发生如下反应:2L(g)+3M(g) ![]() xQ(g)+3R(g),10 s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
xQ(g)+3R(g),10 s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
(1)10 s末L的物质的量浓度为________。
(2)前10 s内用M表示的化学反应速率为________。
(3)化学方程式中x值为________。
(4)在恒温恒容条件下,往容器中加入1 mol氦气,反应速率________(填“增大”、“减小”或“不变”,下同)。
(5)在恒温恒压条件,往容器中加入1 mol氦气,反应速率________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
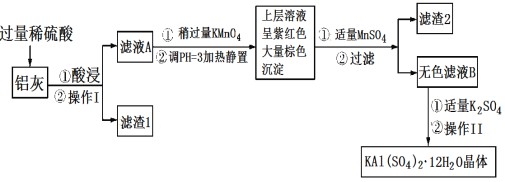
(1)明矾净水的原理是______________(用离子方程式表示)。
(2)操作Ⅰ是________,操作Ⅱ是蒸发浓缩、__________、过滤、洗涤、干燥。
(3)检验滤液A中是否存在Fe2+的试剂是__________(只用一种试剂)。
(4)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是__________,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4-转化为Mn2+):_______。
(5)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:________,滤渣2含有的物质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
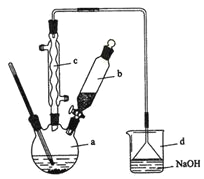
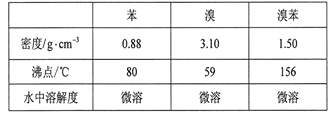
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了__________气体。继续滴加至液溴滴完。装置d的作用是__________________________________________;
(2)该反应的化学方程式:__________________________________________。
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用l0 mL水、8 mL l0%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是__________________________;
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为_______,要进一步提纯,下列操作中必须的是______(填入正确选项前的字母);
A重结晶 B过滤 C蒸馏 D萃取
(5)在该实验中,a的容积最适合的是______(填入正确选项前的字母)。
A.25 mL B .50 mL C. 250 mL D. 509 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84g/cm3)配制100mL 1.0mol/L的稀硫酸,现给出下列仪器(配制过程中可能用到):
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶
E.10mL量筒F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
(1)需量取浓硫酸的体积为________mL
(2)实验时选用的仪器有________
(3)配制过程中,下列情况会使配制结果偏高的是________ (填序号)
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
④量取浓硫酸时仰视量简刻度
⑤移液时未洗涤烧杯和玻璃棒
(4)在容量规使用方法中,下列操做不正确的是________ (填序号)
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶
D.将准确量取的18.4mol/L的硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com