
【题目】草酸是“消字灵”的主要成分之一,其分子构成如图.下列关于草酸的叙述不正确的是( )
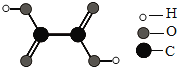
A. 草酸属于有机物
B. 草酸的化学式为H2C2O4
C. 一个草酸分子由2个氢原子、2个碳原子、4个氧原子构成
D. 草酸的摩尔质量为90 g
【答案】D
【解析】
A、根据有机物的概念进行分析;B、利用分子结构模型图及图例,查找构成分子的原子种类和数目,根据分子构成写出物质的化学式;C、根据化学式的意义进行分析;D、依据摩尔质量的概念分析判断。
A、从分子模型的可以看出,草酸是含有碳元素的化合物,属于有机物,故说法正确;B、在分子模型可以看出,一个草酸分子中含有2个C原子、2个H原子、4个O原子,故其化学式可写为H2C2O4,故说法正确;C、草酸是由草酸分子构成的,一个草酸分子是由2个C原子、2个H原子、4个O原子构成的,故说法正确;D、1×2+12×2+16×4=90,草酸的摩尔质量为90 g/mol,故说法不正确。答案选D。


科目:高中化学 来源: 题型:
【题目】描述弱电解质电离情况可以用电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1
酸或碱 | 电离平衡常数(Ka或Kb) |
CH3COOH | 1.8×10﹣5 |
HNO2 | 4.6×10﹣4 |
HCN | 5×10﹣10 |
HClO | 3×10﹣8 |
NH3H2O | 1.8×10﹣5 |
表2
难(微)溶物 | 溶度积常数(Ksp) |
BaSO4 | 1×10﹣10 |
BaCO3 | 2.6×10﹣9 |
CaSO4 | 7×10﹣5 |
CaCO3 | 5×10﹣9 |
请回答下列问题:
(1)表1所给的四种酸中,酸性最弱的是_____(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是___(填字母序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈_____(选填“酸性”、“中性”或“碱性”),该溶液中存在的各离子浓度大小关系为_____。
(3)物质的量之比为1:1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子浓度从大到小的顺序为_____。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成可溶性的钡盐(如BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度不小于0.01molL﹣1,则溶液中CO32-物质的量浓度最少应为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔质量是指单位物质的量的物质所具有的质量,已知NA为阿伏加德罗常数的值,请回答下列问题:
(1)已知NH3的相对分子质量为17,则NH3的摩尔质量为________。
(2)已知一个铁原子的质量为b g,则铁原子的摩尔质量为________。
(3)已知a g某气体中含分子数为b,则该气体的摩尔质量为________。
(4)有以下四种物质:①22 g二氧化碳 ②8 g氢气 ③1.204×1024个氮气分子 ④4 ℃时18 mL水
它们所含分子数最多的是__________,所含原子数最多的是________,质量最大的是________,所含电子数最多的是________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两种有机物(结构简式如下图),下列说法不正确的是
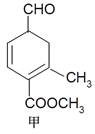

A. 二者与溴的CCl4溶液发生加成反应,消耗溴的物质的量分别为2mol、1mol
B. 甲、乙互为同分异构体
C. 1mol甲与H2在一定条件下反应,最多消耗3mol H2
D. 等物质的量的甲、乙分别与NaOH溶液反应,消耗NaOH的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 标准状况下,22.4 L H2O含有的分子数为NA
B. 常温常压下,1.06 g Na2CO3含有的Na+离子数为0.02 NA
C. 通常状况下,NA个CO2分子占有的体积为22.4 L
D. 标准状况下,56 g Fe的体积约为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
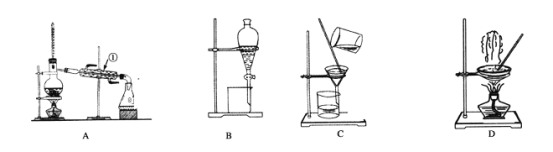
(1)从氯化钾溶液中得到氯化钾固体,选择装置________(填代表装置图的字母,下同);除去自来水中 的Cl-等杂质,选择装置________________。
(2)从碘水中分离出I2,选择装置________,该分离方法的名称为________________。
(3)装置A中①的名称是________,进水的方向是从________口进水。
II.某化学课外小组用海带为原料制取了少量碘水.现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液.其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50 mL碘水和15 mL CCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.放开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层水溶液;
G.将漏斗上口的玻璃塞打开,或使溶液上的凹槽或小孔对准漏斗口上的小孔;
H.静置、分层.
就此实验,完成下列填空:
(1)正确操作步骤的顺序是(用上述各操作的编号字母填空):
________→________→________→A→H→________→E→F._____________
(2)上述E步骤的操作中应注意______________________________________.上述G步骤操作的目的是_____________________________________________.
(3)能选用CCl4从碘水中萃取碘的原因是______________________________________.
(4)下列物质不能作为从溴水中萃取溴的溶剂是________.
A.酒精 B.苯(一种有机溶剂,与水互不相溶,密度比水小) C.汽油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行如下反应:X2(g)+Y2(g) ![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
A. Z为0.3mol/L B. Y2为0.4mol/L
C. X2为0.2mol/L D. Z为0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下图,下列叙述正确的是

A. 若该图表示的是活细胞的各化学元素的含量,则甲为碳元素
B. 若该图表示的是细胞各化学元素占干重的百分比,则甲为氧元素
C. 若该图为活细胞的化合物组成情况,则甲中含有的元素为C、H、0
D. 若该图是完全脱水后的细胞的化合物组成情况,则甲是蛋白质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com