
 如图所示,若锥形瓶内是水,分液漏斗内的液体也是水,向烧杯内滴加水时,发现U形管内液体慢慢右移,恢复到原温度后液面左边与右边基本相平,则烧杯内的物质是( )
如图所示,若锥形瓶内是水,分液漏斗内的液体也是水,向烧杯内滴加水时,发现U形管内液体慢慢右移,恢复到原温度后液面左边与右边基本相平,则烧杯内的物质是( )| A. | 过氧化钠 | B. | 氧化钠 | C. | 钠 | D. | 钾 |
分析 根据物理知识的原理,可知U形管内液体慢慢右移说明容器内压强比外界压强大,恢复到原温度后液面左边与右边基本相平,说明压强又变回原来相等,根据热胀冷缩现象,导致压强变化,但不能产生气体.
解答 解:A、过氧化钠溶于水放出热量并生成氧气,使容器内温度升高,压强增大,U形管内液体慢慢右移,但恢复到原温度后液面左边仍然比右边低,故A错误;
B、氧化钠与水反应放出热量,使容器内温度升高,压强增大,U形管内液体慢慢右移,恢复到原温度后液面左边与右边基本相平,故B正确;
C、钠加入水中放热并生成氢气,使容器内温度升高,压强增大,U形管内液体慢慢右移,但恢复到原温度后液面左边仍然比右边低,故C错误;
D、钾加入水中放热并生成氢气,使容器内温度升高,压强增大,U形管内液体慢慢右移,但恢复到原温度后液面左边仍然比右边低,故D错误.
故选B.
点评 要了解物质溶于水的过程,知道为什么放热和吸热,记住溶于水吸热和放热的常见物质,常见的遇于水放热的有:浓硫酸、生石灰、氢氧化钠固体,难度不大,注意恢复到原温度后液面左边与右边基本相平,所以不能生成气体导致压强增大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 研发易降解的生物农药 | |
| B. | 对燃煤进行脱硫处理 | |
| C. | 对塑料等垃圾进行深埋或倾倒入海处理 | |
| D. | 推广使用节能环保材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
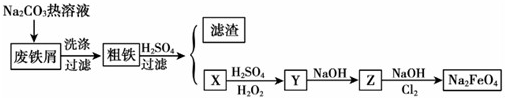
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主要原料:碳酸钙 食用方法:每日一次,每次一片,嚼食. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .该化合物的类型是离子化合物(“离子化合物”或“共价化合物”).
.该化合物的类型是离子化合物(“离子化合物”或“共价化合物”).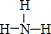 (填结构式).
(填结构式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
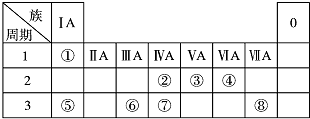 如表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
如表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: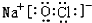 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把没用完的药品倒回原试剂瓶中保存 | |
| B. | 配制稀硫酸时,先在量筒内放好水,再缓缓地加入一定量的浓硫酸 | |
| C. | 用天平称量药品质量时,先加质量大的砝码,再加质量小的砝码 | |
| D. | 用排水取气法收集气体时,导管应插入试管底部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
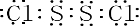 .固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为:Na2O2+Na2S+2H2O=S+4NaOH.
.固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为:Na2O2+Na2S+2H2O=S+4NaOH. 2SO3(g)△H=-197KJ/mol.
2SO3(g)△H=-197KJ/mol.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com