
| A. | 强电解质在水中一定能全部溶解 | |
| B. | Cu能导电,因此Cu是电解质 | |
| C. | 弱电解质溶液的导电性可能比强电解质溶液的导电性强 | |
| D. | NaCl是电解质,故NaCl固体能导电 |
分析 A、强电解质是指在水溶液中或熔融状态下能完全电离的化合物;
B、电解质是在水溶液中或熔融状态下能导电的化合物;
C、导电性的强弱取决于离子浓度大小;
D、物质能导电,要么有自由移动的离子,要么有自由移动的电子.
解答 解:A、强电解质是指在水溶液中或熔融状态下能完全电离的化合物,与溶解性无关,故A错误;
B、电解质是在水溶液中或熔融状态下能导电的化合物,而铜是单质,故不是电解质,故B错误;
C、导电性的强弱取决于离子浓度大小,弱电解质溶液的离子浓度可能比强电解质溶液的离子浓度大,故导电能力可能比强电解质溶液的导电能力强,故C正确;
D、物质能导电,要么有自由移动的离子,要么有自由移动的电子,而氯化钠中无自由移动的离子或电子,故氯化钠固体不能导电,故D错误.
故选C.
点评 本题考查了有关电解质非电解质的知识,明确电解质导电是自身电离出自由移动的离子是解答的关键,题目较简单.


科目:高中化学 来源: 题型:解答题
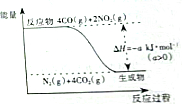 研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义.
研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
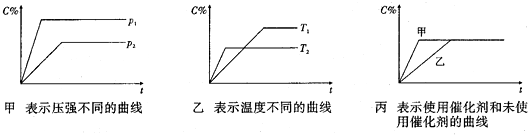

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


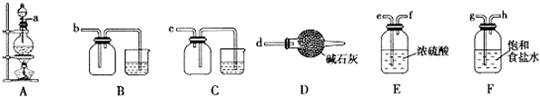
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在中和滴定实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,须经干燥或润洗后方可使用 | |
| B. | 对于pH相同的氢氧化钠和氨水,加水稀释至m倍和n倍后,若稀释后溶液的pH相等,则m>n | |
| C. | 向冰醋酸中加水至配成醋酸稀溶液的过程中H+的浓度逐渐减小 | |
| D. | 25℃时NH4Cl溶液的KW大于100℃时NaCl溶液的KW |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,浓硫酸与铁、铝不反应,所以铁质、铝质容器能盛放浓硫酸 | |
| B. | 浓硫酸具有吸水性,故能使蔗糖碳化 | |
| C. | 浓硫酸和铜片加热既表现出酸性,又表现出氧化性 | |
| D. | 浓H2SO4可做H2、O2等气体的干燥剂表现其脱水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸盐作为食品添加剂作用是防腐保鲜 | |
| B. | 反应①中通入N2的作用是将生成的气体全部赶出 | |
| C. | 测定样品质量及③中耗碱量,可测定样品中亚硫酸盐含量 | |
| D. | 若仅将②中的氧化剂“H2O2溶液”替换为碘水,对测定结果无影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com