

 ;F
;F
 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2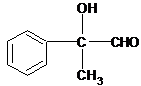 +2H2O
+2H2O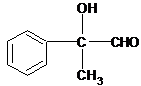 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O
+Cu2O↓+2H2O .
.分析 D与新制备氢氧化铜反应产物可知D应为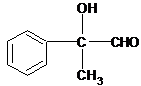

 ,则A为
,则A为

 ,据此分析解答.
,据此分析解答.
解答 解:D与新制备氢氧化铜反应产物可知D应为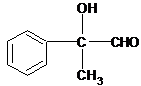

 ,则A为
,则A为

 ,
,
(1)D为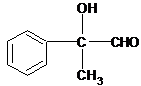
(2)C为
 ,B和KOH的水溶液加热发生消去反应生成C,所以反应条件是KOH水溶液、加热,故答案为:KOH水溶液,加热;
,B和KOH的水溶液加热发生消去反应生成C,所以反应条件是KOH水溶液、加热,故答案为:KOH水溶液,加热;
(3)为



(4)反应③为
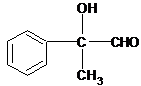

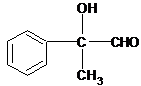
故答案为:2
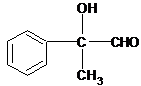
(5)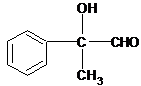
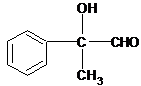
 +Cu2O↓+2H2O,
+Cu2O↓+2H2O,
故答案为: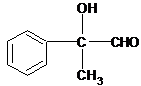
 +Cu2O↓+2H2O;
+Cu2O↓+2H2O;
(6)E为 ,E的同分异构体符合下列条件:
,E的同分异构体符合下列条件:
a.苯环上的一氯代物有两种,说明苯环上含有两种氢原子;
b.遇FeCl3溶液发生显色反应说明含有酚羟基,
c.能与Br2/CCl4发生加成反应说明含有碳碳双键,
符合条件的同分异构体结构简式为 ,
,
故答案为: .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,根据已知某些物质的结构简式、分子式及反应条件采用正逆结合的方法进行推断,难点是同分异构体判断,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 序号、物理量 | M(Fe粉)/g | V[0.05mol.L-1Na2S2O8]/mL | V[H2O]/mL | 收集数据和得出结论 | |
| 1 | 100 | 0.3 | 50 | 50 | |
| 2 | 100V(污水)/mL | 0.3 |
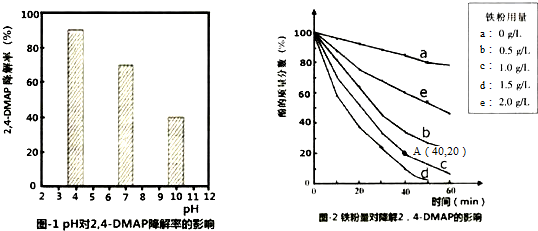
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
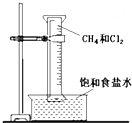 如图所示,用排饱和食盐水法先后收集20ml CH4和 80mlCl2,放在光亮的地方(注意:不要放在日光直射的地方,以免引起爆炸),等待片刻,观察发生的现象.回答下列问题:
如图所示,用排饱和食盐水法先后收集20ml CH4和 80mlCl2,放在光亮的地方(注意:不要放在日光直射的地方,以免引起爆炸),等待片刻,观察发生的现象.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2固体不导电,但在熔融状态下可以导电 | |
| B. | CaCl2的水溶液能导电 | |
| C. | CaCl2易溶于水 | |
| D. | CaCl2在有机溶剂(如苯)中的溶解度极小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 当生成沉淀达到最大量时,消耗NaOH溶液的体积为150mL | |
| B. | 当金属全部溶解时收集到NO气体的体积为0.336L(标准状况下) | |
| C. | 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.6mol | |
| D. | 参加反应的金属的总质量一定是9.9g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,其化学键的类型为离子键、共价键.
,其化学键的类型为离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能:②>③ | B. | 电负性:③>② | ||
| C. | 晶格能:NaCl>NaF | D. | 最高正化合价:③>① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com