
【题目】下列说法正确的是
A.既有单质参加又有单质生成的反应一定是氧化还原反应
B.发生了颜色变化的一定是化学变化
C.用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐不涉及化学变化
D.根据丁达尔现象可以将分散系分为溶液、胶体和浊液
科目:高中化学 来源: 题型:
【题目】铬是一种银白色的坚硬金属,铬的工业用途很广,主要有金属加工、电镀、制革行业,这些行业排放的废水和废气是环境中的主要污染源。请回答下面与铬有关的一些问题。
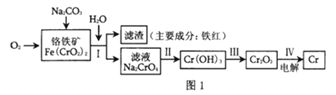
(1)工业上冶炼铬的主要步骤如图1所示:
①已知步骤Ⅱ的反应方程式为:8Na2CrO4+6Na2S+23H2O=8Cr(OH)3↓+3Na2S2O3+22NaOH。该反应中氧化剂是___(填化学式),生成1molCr(OH)3时转移电子的物质的量为___mol;
②步骤IV中电解Cr2O3的阳极反应式为___;
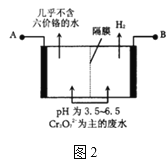
(2)某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如图2,A为电源的___(填“正极”“负极”),阳极区溶液中发生的氧化还原反应为___。
(3)化学需氧量(COD)可量度水体受有机物污染的程度。它是在强酸并加热条件下,用K2Cr2O7作强氧化剂处理水样时所消耗的K2Cr2O7的量,换算成相当于O2的含量(以mg/L计)。某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
Ⅰ.取VamL水样于锥形瓶,加入10.00mL0.2500mol/L K2Cr2O7溶液;
Ⅱ.加碎瓷片少许,然后慢慢加入少量硫酸,混合均匀,加热;
Ⅲ.反应完毕后,冷却,加指示剂,用cmol/L的硫酸亚铁铵(NH4)2Fe(SO4)2溶液滴定。终点时消耗硫酸亚铁铵溶液VbmL(此步操作的目的是用Fe2+把多余的Cr2O72-反应成Cr3+)。
①Ⅰ中,量取K2Cr2O7溶液的仪器是___;
②Ⅱ中,碎瓷片的作用是___;
③该水样的化学需氧量COD=___(用含c、Va、Vb的表达式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定微粒的数目相等的是
A.等物质的量的12CO2与14CO2含有的中子数
B.同温、同压、同体积的CO2和N2O含有的质子数
C.等质量的己烷和丁烷中含有的共用电子对数
D.等物质的量的钠和铁分别与足量氯气完全反应时转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】坦桑石是一种世界公认的新兴宝石,这种宝石于1967年首次在赤道雪山脚下的阿鲁沙地区被发现。坦桑石的主要化学成分为![]() ,还可含有V、Cr、Mn等元素。
,还可含有V、Cr、Mn等元素。
![]() 下列状态的铝中,电离最外层的一个电子所需能量最大的是________
下列状态的铝中,电离最外层的一个电子所需能量最大的是________![]() 填序号
填序号![]() 。
。
①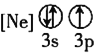 ②
②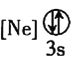 ③
③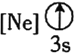 ④
④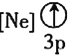
![]() 烟酸铬是铬的一种化合物,其合成过程如下:
烟酸铬是铬的一种化合物,其合成过程如下:
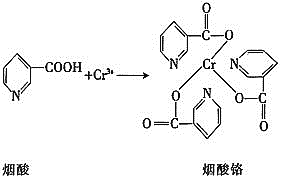
![]() 核外电子排布式为________。
核外电子排布式为________。
![]() 、C、N、O的电负性由大到小的顺序是_________。
、C、N、O的电负性由大到小的顺序是_________。
![]() 烟酸中碳、氮原子的杂化方式分别为________、________。
烟酸中碳、氮原子的杂化方式分别为________、________。
![]() 分子中的大
分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数
键的电子数![]() 如二氧化碳分子中的大
如二氧化碳分子中的大![]() 键可表示为
键可表示为![]() ,则烟酸中的大
,则烟酸中的大![]() 键应表示为___________。
键应表示为___________。
![]() 、
、![]() 都极易水解。
都极易水解。![]() 、
、![]() 都属于______
都属于______![]() 填“极性”或“非极性”
填“极性”或“非极性”![]() 分子,其熔点的关系为
分子,其熔点的关系为![]() ________
________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 将Mn掺入GaAs晶体
将Mn掺入GaAs晶体![]() 图甲
图甲![]() 可得到稀磁性半导体材料
可得到稀磁性半导体材料![]() 图乙
图乙![]() ,图甲、图乙晶体结构不变。
,图甲、图乙晶体结构不变。
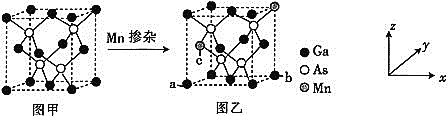
![]() 图乙中a点和b点的原子坐标参数分别为
图乙中a点和b点的原子坐标参数分别为![]() 0,
0,![]() 和
和![]() 1,
1,![]() ,则c点的原子坐标参数为________。
,则c点的原子坐标参数为________。
![]() 设图甲晶体的密度为
设图甲晶体的密度为![]() ,用
,用![]() 表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个镓原子之间的距离为________________pm。
表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个镓原子之间的距离为________________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
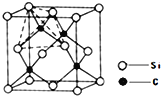
【题目】太阳能电池的发展已经进入了第三代。第三代就是铜铟镓硒CIGS等化合物薄膜太阳能电池以及薄膜硅系太阳能电池。完成下列填空:
(1)亚铜离子(Cu+)基态时的电子排布式为____________;
(2)硒为第四周期元素,相邻的元素有砷和溴,则这3种元素的第一电离能I1从大到小顺序为(用元素符号表示)_______________________________;用原子结构观点加以解释_________________________。
(3)与镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具 有孤对电子的分子或离子生成加合物,如BF3能与NH3反应生成BF3NH3 。BF3NH3中B原子的杂化轨道类型为__________,N原子的杂化轨道类型为 ______________ ,B与 N之间形成 __________________ 键。
(4)单晶硅的结构与金刚石结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子不成键,则得如图所示的金刚砂(SiC)结构;金刚砂晶体属于____________(填晶体类型)在SiC结构中,每个C原子周围最近的C原子数目为 ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组研究溶液中Fe2+与![]() 、
、![]() 的反应。
的反应。

已知:[Fe(NO)]2+在溶液中呈棕色。
(1)研究现象a中的黄色溶液。
①用__________溶液检出溶液中含有Fe3+。
②甲认为是O2氧化了溶液中的Fe2+。乙认为O2不是主要原因,理由是_____________。
③进行实验Ⅱ,装置如图所示。左侧烧杯中的溶液只变为黄色,不变为棕色,右侧电极上产生无色气泡,经检验该气体为NO。产生NO的电极反应式为_______实验Ⅱ的目的是________。

(2)研究现象a中的棕色溶液。综合实验I和实验Ⅱ,提出假设:现象a中溶液变为棕色可能是NO与溶液中的Fe2+或Fe3+发生了反应。进行实验Ⅲ,证实溶液呈棕色只是因为Fe2+与NO发生了反应。实验Ⅲ的操作和现象是_______。
(3)研究酸性条件下,溶液中Fe2+与![]() 、
、![]() 的反应。
的反应。
序号 | 操作 | 现象 |
i | 取1 mol·L-l的NaNO2溶液,加稀硫酸至pH = 3,加入1 mol·L-l FeSO4溶液 | 溶液立即变为棕色 |
ii | 取1 mol·L-l的NaNO3溶液,加硫酸至pH = 3,加入1 mol·L-l FeSO4溶液 | 无明显变化 |
iii | 分别取0.5 mL l mol·L-l的NaNO3溶液与1 mol·L-l的FeSO4溶液,混合,小心加入0.5 mL浓硫酸 | 液体分为两层,稍后,在两层液体界面上出现棕色环 |
i中溶液变为棕色的离子方程式为_______、__________。
实验结论:本实验条件下,溶液中![]() 、
、![]() 的氧化性与溶液的酸碱性等有关。
的氧化性与溶液的酸碱性等有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A. 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
B. ![]() =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C. 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
D. 水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO2-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
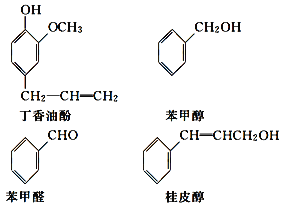
【题目】水仙花所含的挥发油中含有丁香油酚、苯甲醇、苯甲醛、桂皮醇等成分。它们的结构简式如下:
请回答下列问题:
(1)①丁香油酚中含氧的官能团是_____;丁香油酚可能具有的性质是_____(填字母)。
A.可与烧碱反应
B.只能与Br2发生加成反应
C.既可燃烧,也可使酸性KMnO4溶液褪色
D.可与NaHCO3溶液反应放出CO2气体
②从结构上看,上述四种有机物中与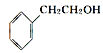 互为同系物的是____(填名称)。
互为同系物的是____(填名称)。
(2)苯甲醛经________(填反应类型)反应可得到苯甲醇。写出苯甲醛和银氨溶液反应化学方程式为___________________________________。III
(3)由桂皮醇转化为丙的过程为(已略去无关产物)
桂皮醇![]()
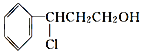
![]() 甲
甲![]() 乙
乙![]() 丙
丙
如果反应Ⅱ为消去反应,则反应Ⅱ的条件是_______________,反应Ⅲ为加聚反应,则高聚物丙的结构简式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常用作风信子等香精的定香剂D以及可用作安全玻璃夹层的高分子化合物PVB的合成路线如下:
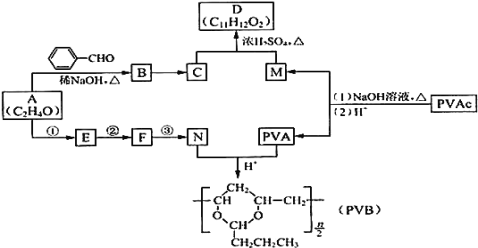
已知:Ⅰ.RCHO+R’CH2CHO![]()
![]() +H2O(R、R’表示烃基或氢)
+H2O(R、R’表示烃基或氢)
Ⅱ.醛与二元醇![]() 如:乙二醇
如:乙二醇![]() 可生成环状缩醛:RCHO+HOCH2CH2OH
可生成环状缩醛:RCHO+HOCH2CH2OH![]()
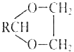 +H2O
+H2O
⑴A的核磁共振氢谱有两种峰.A的名称是 ______
⑵下列关于B的说法正确的是 ______
a.分子式为C9H8O b.所有原子均可在同一平面上
c.最多可以与5molH2发生反应 d.可以使溴水褪色
⑶C为反式结构,由B还原得到。C的结构简式是 ______
⑷G与D含有相同的官能团,相对分子量比D小28,则G的结构有 ______ 种![]() 不包括立体异构
不包括立体异构![]()
⑸E能使Br2的CCl4溶液褪色,N由A经反应①③合成。
a.②的反应类型是 ______
b.③的化学方程式是 ______
⑹PVAc由一种单体经加聚反应得到,该单体的结构简式是 ______
⑺碱性条件下,PVAc完全水解的化学方程式是 ______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com