
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入稀盐酸无明显现象,再加入氯化钡溶液有白色沉淀产生,一定有SO42- | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加入盐酸白色沉淀消失,一定有Ba2+ |
分析 A.生成的气体可能为二氧化碳或二氧化硫,原溶液中可能含有碳酸氢根离子、硫酸根离子,不一定含有碳酸根离子;
B.加入稀盐酸排除了干扰离子,然后加入氯化钡溶液,生成的白色沉淀一定为硫酸钡,溶液中一定含有硫酸根离子;
C.生成的气体一定为氨气,溶液中一定含有铵根离子;
D.该离子可能为钙离子,不一定为钡离子.
解答 解:A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,该气体可能为二氧化硫,原溶液中可能含有亚硫酸根离子、亚硫酸氢根离子,不一定含有CO32-,故A错误;
B.加入稀盐酸无明显现象,排除了碳酸根离子、银离子等干扰,再加入氯化钡溶液有白色沉淀产生,该沉淀一定为硫酸钡,原溶液中一定有SO42-,故B正确;
C.加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,该气体为氨气,则原溶液中一定有NH4+,故C正确;
D.加入碳酸钠溶液产生白色沉淀,再加入盐酸白色沉淀消失,生成的沉淀可能为碳酸钙,不一定为碳酸钡,原溶液中可能含有Ba2+,故D错误;
故选BC.
点评 本题考查了常见离子的检验方法,题目难度不大,明确常见离子的性质及检验方法为解答关键,注意检验离子存在时,必须排除干扰离子,确保检验方案的严密性.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤⑥ | B. | ②③④⑥ | C. | ①②④⑤ | D. | ①②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该装置为原电池 | |
| B. | a极上发生还原反应 | |
| C. | 电子由b→a | |
| D. | 该过程中能量的转换只有化学能与电能的转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1-丙醇与浓氢溴酸反应:CH3CH2 CH2OH+HBr$\stackrel{△}{→}$CH3CH2 CH2Br+H2O | |
| B. | 1-溴丙烷与氢氧化钠溶液共热:CH3CH2 CH2Br+NaOH$→_{△}^{水}$CH3CH2 CH2OH+NaBr | |
| C. | 苯酚钠中通入少量二氧化碳:2 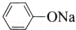 +CO2+H2O→2 +CO2+H2O→2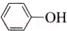 +Na2CO3 +Na2CO3 | |
| D. | 蔗糖在稀硫酸作用下水解:C12H22O11(蔗糖)+H2O$→_{△}^{稀硫酸}$C6H12O6(果糖)+C6H12O6(葡萄糖) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20:1 | B. | 1:20 | C. | 10:1 | D. | 1:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| B. | 在2+离子中,Cu2+给出孤对电子,NH3提供空轨道 | |
| C. | 用硝酸铜溶液代替硫酸铜溶液进行实验,不能观察到同样的现象 | |
| D. | 沉淀溶解后,将生成深蓝色的配合离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一定条件下,根据溶液导电性的变化,可以判断出电解质的强弱.已知溶液的导电性与溶液自由移动离子的浓度及其所带电荷有关.离子浓度越大,所带电荷越多,导电性就越强,如图是将KOH溶液分别加入到相同物质的量浓度的HCl溶液和CH3COOH溶液中的导电性变化情况.下列说法正确的是( )
在一定条件下,根据溶液导电性的变化,可以判断出电解质的强弱.已知溶液的导电性与溶液自由移动离子的浓度及其所带电荷有关.离子浓度越大,所带电荷越多,导电性就越强,如图是将KOH溶液分别加入到相同物质的量浓度的HCl溶液和CH3COOH溶液中的导电性变化情况.下列说法正确的是( )| A. | 虚线表示CH3COOH溶液,实线表示HCl溶液 | |
| B. | 由图可知,HCl溶液中加入KOH溶液后导电性将进一步增强 | |
| C. | 由图可知,加入KOH溶液到一定量后,导电性均会比原来强 | |
| D. | 若用NH3•H2O溶液加入到HCl溶液中,则导电性变化如图 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com