
| A. | 鉴别1-溴丙烷和2-溴丙烷能通过核磁共振仪鉴别,不能用红外光谱仪鉴别 | |
| B. | 仅用物理方法无法鉴别乙醇、甲苯、硝基苯 | |
| C. | 仅用一种试剂能鉴别乙醇、苯、苯酚、2-己烯和四氯化碳 | |
| D. | 用KMnO4酸性溶液能鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO |
分析 A.1-溴丙烷和2-溴丙烷中H的种类分别为3、2;
B.水与乙醇互溶,水与甲苯分层后有机层在上层,水与硝基苯分层后有机层在下层;
C.溴水分别与乙醇、苯、苯酚、2-己烯和四氯化碳混合的现象为:互溶、分层后有机色层在上层、白色沉淀、溶液褪色、分层后有机色层在下层;
D.碳碳双键、-OH、-CHO均能被高锰酸钾氧化.
解答 解:A.1-溴丙烷和2-溴丙烷中H的种类分别为3、2,则核磁共振仪可鉴别,而化学键、官能团相同,不能用红外光谱仪鉴别,故A正确;
B.水与乙醇互溶,水与甲苯分层后有机层在上层,水与硝基苯分层后有机层在下层,则利于物理方法可鉴别,故B错误;
C.溴水分别与乙醇、苯、苯酚、2-己烯和四氯化碳混合的现象为:互溶、分层后有机色层在上层、白色沉淀、溶液褪色、分层后有机色层在下层,现象不同,可鉴别,故C正确;
D.碳碳双键、-OH、-CHO均能被高锰酸钾氧化,则高锰酸钾不能鉴别,故D错误;
故选AC.
点评 本题考查有机物的鉴别,为高频考点,把握有机物的性质、性质差异、发生的反应及现象为解答的关键,侧重分析与应用能力的考查,注意有机物性质的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
 室温下,用相同浓度的NaOH溶液,分别滴定等体积,浓度均为0.1mol/L的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示.下列判断正确的是( )
室温下,用相同浓度的NaOH溶液,分别滴定等体积,浓度均为0.1mol/L的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示.下列判断正确的是( )| A. | 三种酸的强弱顺序:HA<HB<HD | |
| B. | 滴定至P点时,溶液中:c(B-)>c(Na+)>c(H+)>c(OH-) | |
| C. | pH=7时,消耗NaOH溶液的体积:HA<HB<HD | |
| D. | 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)═c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①和④ | B. | 只有①和③ | C. | 只有①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 气态氢化物的稳定性:Z>W>X>Y | |
| C. | W的最高正化合价与负化合价的绝对值可能相等 | |
| D. | 若X位于第VA族,则沸点:XH3<WH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素原子核外共有5个电子层 | |
| B. | 该元素原子最外层共有3个电子 | |
| C. | 该元素原子的M能层共有8个电子 | |
| D. | 该元素原子处于能量最低状态时,原子中共有3个未成对电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、油脂及其水解产物均不属于电解质 | |
| B. | 葡萄糖可用于补钙药物制剂的合成 | |
| C. | 石油是复杂的混合物,其分馏产物为纯净物 | |
| D. | 天然气的产量用来衡量一个国家石油化工的发展水平 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
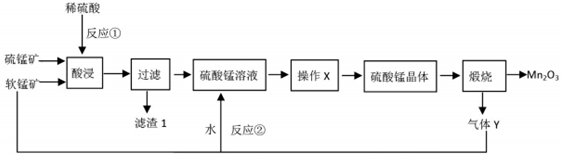
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com