
| A. | 铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀 | |
| B. | 钢管与电源正极连接,钢管可被保护 | |
| C. | 钢管与铜管露天堆放在一起时,钢管不易被腐蚀 | |
| D. | 钢铁发生析氢腐蚀时,负极反应式:2H+-2e-=H2↑ |
分析 A.常温下,铁和浓硝酸发生钝化现象而阻止进一步反应;
B.用电解原理保护金属时,金属应作电解池阴极;
C.构成原电池负极的金属易被腐蚀;
D.钢铁发生析氢腐蚀时,负极上铁失电子生成亚铁离子.
解答 解:A.常温下,铁和浓硝酸反应生成一层致密的氧化物薄膜而阻止了进一步反应,所以可以保护内部金属不被腐蚀,故A正确;
B.用电解原理保护金属时,金属应作电解池阴极,应该与原电池负极连接,故B错误;
C.钢管、铜管和雨水能构成原电池,铁作原电池负极而容易被腐蚀,故C错误;
D.钢铁发生析氢腐蚀时,负极反应是Fe-2e-═Fe2+,故D错误;
故选A.
点评 本题以金属的腐蚀与防护为载体考查了原电池和电解池原理,注意铁和铝的钝化现象不是没反应而是反应生成一层致密的氧化物薄膜而阻止了进一步反应,为易错点.


科目:高中化学 来源: 题型:多选题
| 氨碱法 | 联合制碱法 | ||
| A. | 原料 | 食盐、氨气、生石灰 | 食盐、氨气、二氧化碳 |
| B. | 副产物 | 氯化钙 | 氯化铵 |
| C. | 循环物质 | 氨气、二氧化碳 | 氯化钠 |
| D. | 评价 | 原料易得;设备复杂;能耗高 | 原料利用率高;废弃物少 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
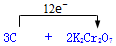 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
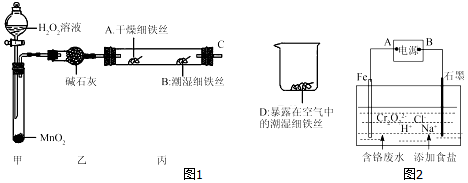
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路” | |
| B. | 我国油品从国IV汽油升级到国V汽油,有助于减少酸雨、雾霾,提高空气质量 | |
| C. | 臭氧是氧化性极强的淡蓝色气体,可用作自来水的消毒剂 | |
| D. | 科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代普通DNA链中的P元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸发皿蒸发溶液时,边加热边用玻璃棒搅拌,直到液体全部蒸干 | |
| B. | 蒸馏操作时,应将温度计插入蒸馏烧瓶内混合溶液中 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
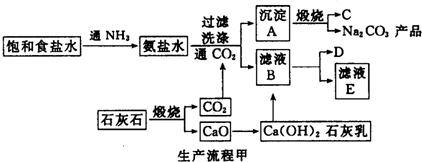

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com