
【题目】(1)某烃A的蒸气密度是同条件下氢气密度的64倍,则A的分子式可能为____,若A中含有6个甲基,但不可能是烯烃与氢气的加成产物,则A的结构简式为______;
(2)已知1mol烃B中所含电子总数为42NA,且C、H两种元素的质量比为5:1,则其分子式为______,它有_____种同分异构体,在它的同分异构体中,沸点最高的是______(写结构简式);一氯代物只有一种的是_____(写习惯名称)。
【答案】C9H20或C10H8 (CH3)3CCH2C(CH3)3 C5H12 3 CH3(CH2)3CH3 新戊烷
【解析】
(1)根据气体的密度之比等于摩尔质量之比确定烷烃A的摩尔质量;根据商余法确定分子式,再根据A中含有6个甲基,确定A的结构简式;
(2)根据C、H两种元素的质量比为5:1,则C、H两种元素的物质的量比为![]() =5:12,可知该烃的实验式为:C5H12,结合实验式和所含电子总数确定分子式;支链越多,沸点越低。
=5:12,可知该烃的实验式为:C5H12,结合实验式和所含电子总数确定分子式;支链越多,沸点越低。
(1)烃A的蒸气密度是相同状况下氢气密度的64倍,则该烃的相对分子质量是氢气的64倍,为128,根据商余法确定A中分子式为C9H20或C10H8;若A中含有六个甲基,A不是烯烃与氢气加成的产物,说明A中相邻C原子之间不可能同时连有氢原子,确定A的结构简式为(CH3)3CCH2C(CH3)3;
答案:C9H20或C10H8 (CH3)3CCH2C(CH3)3
(2)C、H两种元素的质量比为5:1,则C、H两种元素的物质的量比为![]() =5:12
=5:12
,可知该烃的实验式为:C5H12,1mol烃B中所含电子总数为42NA,设B分子式为(C5H12)x,则5x×6+12x×1=42,得x=1;因此分子式为C5H12,有3种同分异构体,分别为正戊烷、异戊烷、新戊烷;支链越多,沸点越低,沸点最高的结构简式为CH3(CH2)3CH3,一氯代物只有一种的是新戊烷。
答案:C5H12 3 CH3(CH2)3CH3 新戊烷


科目:高中化学 来源: 题型:
【题目】一密闭容器中盛有甲烷,在隔绝空气条件下长时间加热到1000℃左右(假使甲烷完全分解),然后恢复至室温(20℃)。这时容器内气体的压强是原来甲烷压强的m倍,原来甲烷的密度是容器内气体密度的n倍。下列判断正确的是( )
A.m=2,n=0.25B.m=0.5,n=4C.m=2,n=4D.m=0.5,n=0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质均为常见物质或它们的溶液,其中 A为淡黄色固体, C、X 均为无色气体,Z为浅绿色溶液,D为一种常见的强碱,F物质不溶于水。根据它们之间的转化关系(下图),回答下列问题:
(部分反应物与产物已省略)
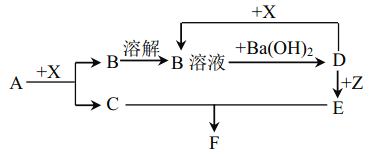
(1)写出下列物质的化学式:X____________ F______________
(2)向Z 溶液中通入足量的Cl2,写出检验所得溶液中阳离子所需试剂_______________________。
(3)向含 10g D 的溶液中通入一定量的 X,完全反应后,在低温条件下蒸发结晶,最终得到 14.8g 固体。
①简述蒸发结晶在低温条件下进行的理由:____________________________________________________(用必要的文字回答)
②所得固体中含有的物质及其它们的物质的量之比为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列说法正确的是( )
A.1molFe与足量的Cl2反应转移的电子数为2NA
B.标准状况下,22.4L H2O中含有的分子数为NA
C.常温、常压下,39gNa2O2中含有的离子总数为1.5NA
D.1.0mol/L NaOH溶液中含有的氧原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铜制品在潮湿环境中发生的电化学腐蚀过程可表示为如图,腐蚀后有A物质生成,某小组为分析A物质的组成,进行了如下实验:
实验①:取A样品,加过量稀硝酸完全溶解后,再加入![]() 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。
实验②:另取A样品4.29g,加入含![]() 的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
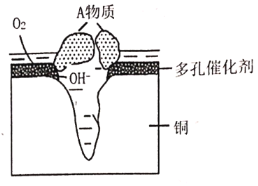
(1)该粉状锈中除了铜元素外还含有(写元素符号)___元素,该铜制品发生电化学腐蚀生成粉状锈时其正极电极反应式为____。
(2)写出该粉状锈溶于稀硫酸反应的离子方程式____。
(3)加热条件下,实验②中所得的黑色固体能与乙醇反应,化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某澄清溶液含有下列离子中的5种(忽略水的电离及离子的水解),K+、Na+、Ag+、Cu2+、Al3+、Cl-、CO32-、NO3-、SO42-,测得各种离子的物质的量浓度相等.为探究溶液中离子组成,某同学进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰。
②另取溶液加入足量稀盐酸,溶液中阴离子种类不变。
③另取溶液加入BaCl2溶液,有白色沉淀生成。
④另取溶液倒入足量的高浓度氢氧化钠,无明显现象,后再加入适量盐酸有白色絮状物生成。根据上述实验,以下推测正确的是( )
A.溶液中无法确定NO3-的存在B.原溶液中不含的离子为:K+、Ag+、Cu2+、CO32-
C.步骤①中可以确定Na+的存在D.步骤③中共有2种钡盐沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用图甲装置制取氨气并探究氨气的有关性质。

(1)装置A中烧瓶内试剂可选用__(填序号)。
a.碱石灰 b.浓硫酸 c.五氧化二磷 d.氯化钙
(2)若探究氨气的溶解性,当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是__。不能在K2的导管末端连接图乙中的__装置(填序号)。
(3)若探究氨气的还原性,需关闭K1、K3,K2连接纯净、干燥氯气的装置。
①用二氧化锰与浓盐酸制取氯气,生成的气体必须依次通过盛有__试剂和__试剂的洗气瓶。
②D中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为__。
③尾气可用C装置处理,若尾气中含有少量Cl2,则C装置中应盛放__溶液(填化学式),反应的离子方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下在4 L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
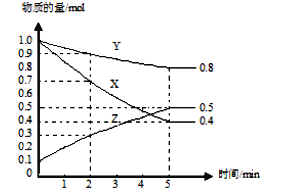
(1)该反应的化学方程式是_____________________________。
(2)该反应达到平衡状态的标志是________(填字母)。
A.Y的体积分数在混合气体中保持不变
B.X、Y的反应速率比为3∶1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成1 mol Y的同时消耗2 mol Z
(3)计算2 min内,Y的转化率为_____________;用物质X表示反应的平均速率为___________;用物质Z表示反应的平均速率为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲测定室温下(25 ℃、101 kPa)的气体摩尔体积,请回答以下问题。
该小组设计的简易实验装置如图所示:
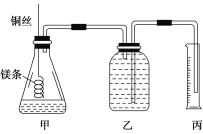
该实验的主要操作步骤如下:
①配制100 mL 1.0 mol/L的盐酸溶液;
②用________(填仪器名称并注明规格)量取10.0 mL 1.0 mol/L的盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为________;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题。
(1)用文字表述实验步骤④中检查装置气密性的方法:
___________________________________________________
(2)实验步骤⑤中应选用________(填序号)的量筒。
A.100 mol B.200 mL C.500 mL
读数时除恢复到室温外,还要注意_________________________________________。
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算式为Vm=________,若未除去镁条表面的氧化膜,则测量结果________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com