
| A、2 | B、2.3 |
| C、2.6 | D、2.9 |
| x×10-2-0.5x×10-2 |
| x+y |
| 0.5x×10-2 |
| 4x |
| 10 |
| 8 |


科目:高中化学 来源: 题型:
| A、Fe2+ Al3+ ClO- Cl- |
| B、K+Fe3+OH- NO3- |
| C、NH4+ Na+ Br- SO42- |
| D、Na+ H+ SiO32- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、澄清石灰水与过量NaHCO3溶液混合:Ca2++OH-+HCO
| ||
B、向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O=HClO+HSO
| ||
| C、锌和稀硝酸的反应:Zn2++2H+=Zn2++H2 | ||
| D、CuSO4溶液吸收H2S气体:Cu2++H2S=CuS↓+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
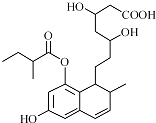
| A、能与FeCl3 溶液发生显色反应 |
| B、能使酸性KMnO4溶液褪色 |
| C、能发生加成、取代、消去反应 |
| D、1mol该物质最多可与3mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、58.5 g的NaCl固体中含有NA个氯化钠分子 |
| B、标准状况下,22.4 L二氯甲烷的分子数约为 NA个 |
| C、1 mol Cl2与足量Fe反应,转移的电子数为3NA |
| D、在反应KIO3+6HI═KI+3I2+3H2O中,每生成3 mol I2转移的电子数为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | L | X | R | T |
| 原子半径/nm | 0.191 | 0.102 | 0.154 | 0.074 |
| 主要化合价 | +1 | +6、-2 | +1 | -2 |
| A、L单质的熔点比R单质的高 |
| B、T对应的氢化物的沸点比X对应的氢化物高 |
| C、R单质在氧气中燃烧生成R2O2 |
| D、L、X形成的简单离子核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有①正确 |
| B、只有③ |
| C、只有①和④ |
| D、①②③④都正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- |
| B、向Mg(HCO3)2溶液中加入过量的澄清石灰水:Mg2++2HCO3-+2OH一+Ca2+═MgCO3↓+CaCO3↓+2H2O |
| C、乙烯的燃烧热为akJ/mol(a>0),则乙烯燃烧的热化学方程式可表示为:C2H4(g)+3O2(g)═2CO2(g)+2H2O(g)△H=-akJ/mol |
| D、Ba(OH)2溶液中加入过量的Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
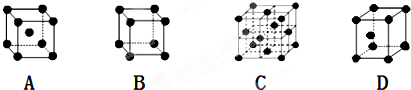
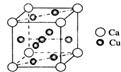 是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为
是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为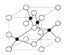 是铜的某种氧化物的晶胞结构示意图,该晶体的密度为a g/cm3,设阿伏伽德罗常数的值为NA,则该晶胞的体积为
是铜的某种氧化物的晶胞结构示意图,该晶体的密度为a g/cm3,设阿伏伽德罗常数的值为NA,则该晶胞的体积为查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com