
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
有关该电池的说法正确的是( )
A.充电过程是化学能转化为电能的过程
B.充电时阳极反应:Ni(OH)2-e-+OH-=NiOOH+H2O
C.放电时负极附近溶液的碱性增强
D.放电时电解质溶液中的OH-向正极移动
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2013-2014湖南省五市十校高一下学期期中教学质量检测化学试卷(解析版) 题型:选择题
将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加少量CuSO4溶液,下图中产生H2的体积V(L)与时间t(min)的关系,其中正确的是

查看答案和解析>>
科目:高中化学 来源:2013-2014湖南师大附中第二学期期中考试高一化学试卷(解析版) 题型:填空题
(12分,每空2分)氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用可产生NaOH和NH3。请回答下列问题:
(1)Na3N的电子式是_______;该化合物是由______键形成的_____(填“离子”或“共价”)化合物。
(2)Na3N与盐酸反应生成__________种盐,对应的反应方程式是 。
(3)比较Na3N中两种微粒的半径:r(Na+)__________r(N3-)(填“>”“=”“<”符号)。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省黄石市秋季高二化学期中统考试卷(解析版) 题型:填空题
(16分)(1)某烃A 0.2 mol在氧气中充分燃烧后,生成化合物B、C各1 mol。
①烃A的分子式为 。
②若取一定量的A完全燃烧后,生成B、C各3 mol,则有 g烃A参加了反应。
③若烃A不能使溴水褪色,但在一定条件下,能与Cl2发生取代反应,其一氯代物只有一种,则A的结构简式为 。
④若烃A能使溴水褪色,在催化剂作用下与H2加成,其加成产物分子中含有3个甲基,则A可能的结构简式为 ;
其中有一种分子中,所有碳原子都在同一平面内,它发生加聚反应的化学方程式为 。
(2).在有机物:①CH3CH3、②CH2=CH2、③CH3CH2C≡CH、④CH3C≡CCH3、⑤C2H6;⑥CH3CH=CH2中,
一定互为同系物的是 ,
一定互为同分异构体的是 。(填编号)
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省黄石市秋季高二化学期中统考试卷(解析版) 题型:选择题
已知,25℃时有关弱酸的电离平衡常数如下:

则下列有关说法正确的是( )
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3 )>pH(CH3COONa)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则b一定大于a
C.向冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度、pH均先增大后减小
D.等物质的量NaHCO3和Na2CO3的混合溶液中,一定存在: c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省黄石市秋季高二化学期中统考试卷(解析版) 题型:选择题
下列热化学方程式中,ΔH能正确表示物质的燃烧热的是( )
A.CO(g)+1/2O2(g)====CO2(g) ΔH=-283.0 kJ·mol-1
B.C(s)+1/2O2(g)====CO(g) ΔH=-110.5 kJ·mol-1
C.H2(g)+1/2O2(g)====H2O(g) ΔH=-241.8 kJ·mol-1
D.2C8H18(l)+25O2(g)====16CO2(g)+18 H2O(l) ΔH=-11036 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高三5月模拟考试理综化学试卷(解析版) 题型:填空题
(16分)实验室中以粗铜(含杂质)为原料,某种制备铜的氯化物的流程如下:

按要求回答下列问题:
(1)操作①的所用到的玻璃仪器有______________。
(2)上述流程中,所得固体1需要加稀盐酸溶解,其理由是 ;
溶液1可加试剂X用于调节pH以除去杂质, X可选用下列试剂中的(填序号)___________。
A.NaOH B.NH3·H2O C.CuO D.CuSO4
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出
制备CuCl的离子方程式: 。
(4)现用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略)。

①按气流方向连接各仪器接口顺序是:a→ 、 → 、 → 、 → 。实验中大试管加热前要进行一步重要操作,其操作是 。
②反应时,盛粗铜粉的试管中的现象是 。
(5)在溶液2转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为绿色。小组同学欲探究其原因。已知:氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq) + 4Cl-(aq)  CuCl42-(aq) + 4 H2O (l)
CuCl42-(aq) + 4 H2O (l)
蓝色 绿色
该同学取氯化铜晶体配成蓝绿色溶液Y,进行如下实验,其中能证明溶液中有上述转化关系的是 (填序号)。
A.将Y稀释,发现溶液呈蓝色 B.在Y中加入CuCl2晶体,溶液变为绿色
C.在Y中加入NaCl固体,溶液变为绿色 D.取Y进行电解,溶液颜色最终消失
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高一下学期期中联考化学试卷(解析版) 题型:选择题
下表是部分短周期元素的原子半径及主要化合价,根据表中信息,下列叙述正确的是
元素代号 | L | M | Q | R | T |
原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.L2+与R2-的核外电子数相等
B.气态氢化物的热稳定性:H2T>H2R
C.M与T形成的化合物能溶于氨水溶液
D.相同条件下,单质与同浓度稀盐酸反应的速率:M>L
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省武汉外国语学校高一下学期期中考试化学试卷(解析版) 题型:选择题
在盛有足量M的体积可变的密容器中加入N,发生反应:M(s)+2N(g)  4P (g)+Q(g)
4P (g)+Q(g)
 <0。在一定温度、压强下达到平衡,平衡时P的物质的量与起始时加入N的物质的量的变化关系如图所示。下列说法正确的是:
<0。在一定温度、压强下达到平衡,平衡时P的物质的量与起始时加入N的物质的量的变化关系如图所示。下列说法正确的是:
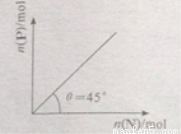
A.平衡时N的转化率为50%
B.当温度升高后,则图中 >45
>45
C.若再加入N,则正、逆反应速率均逐渐增大
D.若再加入N,则反应体系中气体密度减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com