
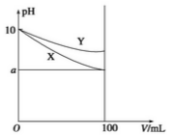
 常温下,pH=10 的X、Y 两种碱溶液各1mL,分别稀释到100mL,其pH 与溶液体积(V)的关系如图所示,下列说法正确的是( )
常温下,pH=10 的X、Y 两种碱溶液各1mL,分别稀释到100mL,其pH 与溶液体积(V)的关系如图所示,下列说法正确的是( )| A. | 若8<a<10,则X、Y 都是弱碱 | |
| B. | 稀释后,X 溶液的碱性比Y 溶液的碱性强 | |
| C. | X、Y 两种碱溶液中溶质的物质的量浓度一定相等 | |
| D. | 分别完全中和X、Y 这两种碱溶液时,消耗同浓度盐酸的体积VX>VY |
分析 常温下,将pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,加水稀释促进弱电解质电离,稀释过程中碱越弱,溶液pH变化越小,根据图知,碱性X>Y,以此解答该题.
解答 解:A.由图可知,开始的pH相同,若8<a<10,则1mL的弱碱加水稀释到100mL,则pH会在原来基础上减一个小于2的值,说明X、Y中都存在电离平衡,是弱碱,故A正确;
B.稀释后X碱溶液pH小于Y溶液的,所以稀释后Y溶液碱性强,故B错误;
C.由图可知,开始的pH相同,两种碱溶液稀释后pH不同,则碱性强弱一定不同,所以物质的量浓度一定不相等,故C错误;
D.pH=10的X、Y两种碱,c(X)<c(Y),相同体积、相同pH的X、Y,n(Y)>n(X),用相同浓度的盐酸中和时,碱的物质的量越大消耗酸体积越大,所以消耗相同浓度盐酸V(X)<V(Y),故D错误.
故选A.
点评 本题考查弱电解质的电离,为高频考点,正确判断碱性强弱是解本题关键,要根据稀释前后pH变化相对大小判断溶液碱性强弱,易错选项是D,难度中等.


科目:高中化学 来源: 题型:实验题
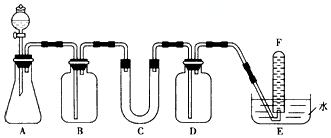
| 仪器 | 加入试剂 | 加入试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| D | 吸收过量CO2 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
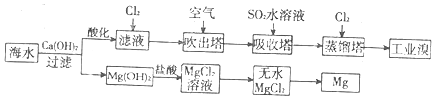
| A. | 若提取1 mol Br2,至少需要标准状况下44.8 L的Cl2 | |
| B. | 工业上常利用电解熔融MgCl2冶炼金属镁 | |
| C. | 富集溴元素过程中,空气吹出法利用了溴易挥发的性质 | |
| D. | 工业溴中含少量Cl2,可用氢氧化钠溶液除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
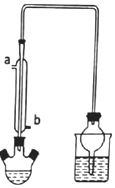 溴乙烷是一种重要的有机化工原料,沸点为38.4℃.实验室可用溴化钠、浓硫酸和乙醉反应制备溴乙烷,实验装置如图(加热和夹持等装置略).
溴乙烷是一种重要的有机化工原料,沸点为38.4℃.实验室可用溴化钠、浓硫酸和乙醉反应制备溴乙烷,实验装置如图(加热和夹持等装置略).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消耗0.8molNaClO3时,转移的电子数为0.8NA | |
| B. | H2O不是氧化产物,也不是还原产物,CO2是还原产物,ClO2是氧化产物 | |
| C. | 氧化剂和还原剂的物质的量之比为4:1 | |
| D. | 每生成1molCO2需转移24mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 现有下列几种有机物:
现有下列几种有机物: .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-的数目为 NA | |
| B. | 0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3 NA | |
| C. | 标准状况下,22.4LH2O含有的分子数为NA | |
| D. | 一定条件下2.3gNa与一定量氧气反应生成Na2O和Na2O2的混合物,转移的电子数一定为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化亚铁溶于稀硝酸:FeO+2H+═Fe2++H2O | |
| B. | 往CaCl2溶液中通入少量的CO2:Ca2++CO2+H2O=CaCO3↓+2H+ | |
| C. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O | |
| D. | 向澄清石灰水中滴加少量的NaHCO3溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com