
| A、硫酸铝溶液与过量Ba(OH)2溶液反应 2Al3++3SO42-+3 Ba2++8OH-=3BaSO4↓+2[Al(OH)4]- |
| B、碳酸钠溶液中滴加盐酸至恰好要出现气泡时停止:CO32-+2H+=CO2↑+H2O |
| C、酸性高锰酸钾溶液与H2O2溶液混合:2MnO4-+3H2O2+6H+=2Mn2++6H2O+02↑ |
| D、氯气通入亚硫酸钠溶液中:2Cl2+SO32-+H2O=2Cl-+SO2↑+2HClO |


科目:高中化学 来源: 题型:
| A、进入煤矿井时,用火把照明 |
| B、用点燃的火柴在液化气钢瓶口检验是否漏气 |
| C、实验桌上的酒精灯倾倒了燃烧起来,马上用湿抹布扑灭 |
| D、实验时,将水倒入浓硫酸中配制稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol任何气体的体积都约是22.4 L |
| B、常温下,28 g氮气所含的原子数目为NA |
| C、在标准状况下,1mol任何物质所占的体积都约为22.4 L?mol-1 |
| D、醋酸的摩尔质量(单位为g?mol-1)与NA个醋酸分子的质量(单位为g)在数值上相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸、水煤气、醋酸、干冰 |
| B、单甘油酯、混甘油酯、苛性钠、氨气 |
| C、冰醋酸、福尔马林、硫酸钠、乙醇 |
| D、胆矾、漂白粉、氯化钾、氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯和乙醇都能发生加聚反应 |
| B、制备乙酸乙酯时,向浓硫酸中缓慢加入乙醇和冰醋酸 |
| C、米酒变酸的过程涉及了氧化反应 |
| D、.K+、MnO4-、CH3CHO和SO42-在酸性条件下大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | Fe3+有强氧化性 | FeCl3溶液可用于回收废旧电路板中的铜 |
| B | SiO2可与HF反应 | 氢氟酸不能保存在玻璃瓶中 |
| C | SO2有漂白性 | SO2可使溴水褪色 |
| D | 浓硫酸有强氧化性 | 浓硫酸可用于干燥H2和CO |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀硫酸与氢氧化钡溶液反应 Ba2++SO42-=BaSO4↓ |
| B、铝与氢氧溶液化钠反应 Al+2OH-=AlO2-+H2↑ |
| C、向Na2CO3浓溶液中缓慢滴加几滴稀盐酸 CO32-+H+=HCO3- |
| D、用氯化铁溶液腐蚀电路板上多余的铜 Cu+Fe3+=Cu2++Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、500 mL,106g |
| B、950 mL,201.4g |
| C、任意规格,201.4g |
| D、1000 mL,212g |
查看答案和解析>>
科目:高中化学 来源: 题型:
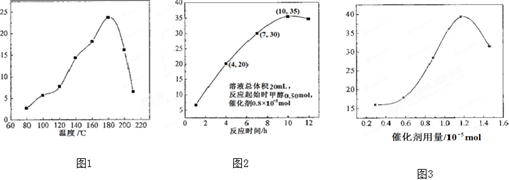
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com