
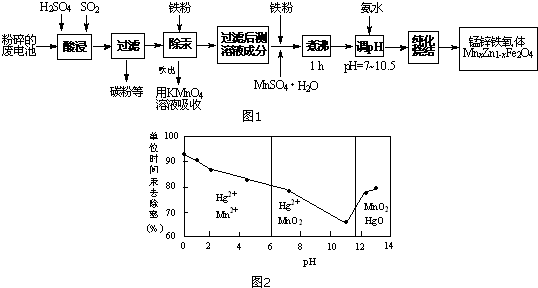
分析 以含锰废旧碱性锌锰电池为原料制备锰锌铁氧体,二氧化硫能与二氧化锰反应生成硫酸锰,过滤除去不溶性杂质碳粉等,滤液中加入铁粉,铁粉具有还原性,能把汞离子还原为汞单质,除去汞,吹出的汞用高锰酸钾溶液吸收,除汞后的溶液加入铁粉、硫酸锰煮沸,纯化烧结得到锰锌铁氧体.
(1)锌锰电池酸浸废电池时,被溶解生成Zn2+的物质有Zn、Zn(OH)2,SO2的作用是还原剂;
(2)①由图可知,pH<6时Hg与酸性高锰酸钾反应生成Hg2+、Mn2+;
②由图可知,随pH值的升高汞的去除率先降低后增加;
(3)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(4)Mn为+2价、Zn为+2价,利用化合价代数和为0,计算Fe元素化合价,再结合Mg、Zn、Fe原子数目之比改写为氧化物形式;结合锰原子守恒可知,补充硫酸锰晶体锰的物质的量等于锰锌铁氧体晶体中锰的物质的量与原废旧碱性锌锰电池中锰元素的物质的量之和,进而计算需补充硫酸锰晶体质量.
解答 解:(1)碱性锌锰干电池工作原理为:Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH,酸浸废电池时,锌被溶解生成Zn2+,Zn(OH)2被溶解生成Zn2+,二氧化硫能与二氧化锰反应生成硫酸锰,SO2的作用是还原剂,
故答案为:Zn、Zn(OH)2;D;
(2)①由图可知,pH<6时Hg与酸性高锰酸钾反应生成Hg2+、Mn2+,反应离子方程式为:5Hg+2MnO4-+16H+=5Hg2++2Mn2++8H2O,
故答案为:5Hg+2MnO4-+16H+=5Hg2++2Mn2++8H2O;
②由图象可知,汞的吸收率随着PH的增大先减小后增大,
故答案为:随pH增大,汞的去除速率先减小后增大;
(3)2MnO(s)+O2(g)═2MnO2(s)△H=-272.0kJ/mol①
MnCO3(s)═MnO(s)+CO2(g)△H=+116.6kJ/mol②
将①+②×2可得:2MnCO3(S)+O2(g)═2MnO2(S)+2CO2(g)△H=[-272.0+2×(+116.6)]kJ/mol=-38.8 kJ/mol;
故答案为:2MnCO3(s)+O2(g)═2MnO2(s)+2CO2(g)△H=-38.8 kJ/mol;
(4)Mn为+2价、Zn为+2价,当x=0.2时,利用化合价代数和为0,可知Fe元素化合价为+3,改写为氧化物形式为:MnO•4ZnO•5Fe2O3,若制得这种锰锌铁氧体的质量为100kg,则锰的物质的量为$\frac{100×0.2}{239}$mol,a kg废旧碱性锌锰电池为原料(含锰元素的物质:MnO2占b%,MnOOH占c%),所含的锰的物质的量为($\frac{a×b%}{87}$$+\frac{ac%}{88}$)mol,所以需补充硫酸锰晶体质量为169×($\frac{20}{239}$-$\frac{ab%}{87}$-$\frac{ac%}{88}$)kg,
故答案为:MnO•4ZnO•5Fe2O3;169×($\frac{20}{239}$-$\frac{ab%}{87}$-$\frac{ac%}{88}$).
点评 本题考查锰锌铁氧体制备工艺,侧重考查物质的分离提纯、对操作的分析评价、读图获取信息能力等,侧重考查学生对知识的迁移运用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 用钢瓶储存液氯或浓硫酸 | |
| B. | 硅胶可用作食品干燥剂 | |
| C. | pM2.5是指大气中直径接近2.5×10-6m的颗粒物,它分散在空气中形成胶体 | |
| D. | 神舟10号飞船所用太阳能电池板的材料是单晶硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
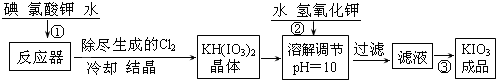
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
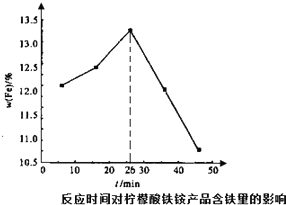 柠檬酸铁铵是一种铁质强化剂,可治疗缺铁性贫血.该盐极易潮解,溶于水,不溶于乙醇、乙醚等有机溶剂,见光易转化为亚铁盐.其实验室制备过程和工业生产流程分别如下:
柠檬酸铁铵是一种铁质强化剂,可治疗缺铁性贫血.该盐极易潮解,溶于水,不溶于乙醇、乙醚等有机溶剂,见光易转化为亚铁盐.其实验室制备过程和工业生产流程分别如下:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60% | B. | 40% | C. | 30% | D. | 70% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com