
| A、溶液中由水电离出的OH一离子浓度c(OH一)=1×10一10?L-1 |
| B、溶液中存在:c(H+)?c(OH一)=l×10-14mol2?L-2 |
| C、溶液中存在:c(Na+)>c(CH3COO一)>c(OH一)>c(H+)>c(CH3COOH) |
| D、溶液中存在:c(CH3COOH)+c(CH3COO一)=c(Na+) |
| Kw |
| c(H+) |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
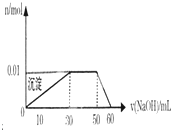 某无色溶液中只可能含有NH4+、K+、Al3+、Mg2+、Fe3+、Cl-、CO32-、SO42-等离子中的几种离子.
某无色溶液中只可能含有NH4+、K+、Al3+、Mg2+、Fe3+、Cl-、CO32-、SO42-等离子中的几种离子.| A、实验中NaOH溶液的物质的量浓度为0.lmol/L |
| B、实验中无法确定K+的存在 |
| C、溶液中一定不存在的离子有Cl-、Fe3+、Mg2+、K+、CO32- |
| D、溶液中一定存在的离子有K+、NH4+、Al3+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
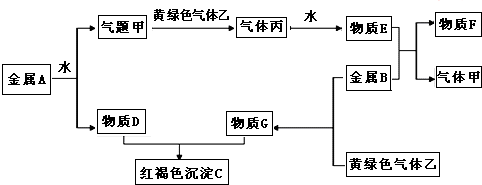
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、②④⑥ |
| C、①③④ | D、③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
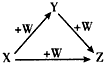
| A、①② | B、②③ | C、③④ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从海带中提取碘单质的过程涉及氧化还原反应 |
| B、高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
| C、利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
| D、绿色化学的核心是应用化学原理对环境污染进行治理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
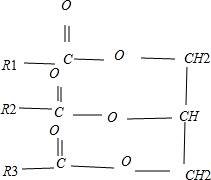 ,R1、R2、R3均不相同,关于该物质的叙述不正确的是( )
,R1、R2、R3均不相同,关于该物质的叙述不正确的是( )| A、油脂在人体内最终转化为水和二氧化碳 |
| B、该甘油酯称为混甘油酯 |
| C、与氢氧化钠溶液混合加热能得到肥皂的主要成分 |
| D、与其互为同分异构且完全水解后产物相同的油脂有四种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com