
【题目】碳酸亚乙酯是一种重要的添加剂,其结构简式为![]() 。用环氧乙烷合成碳酸亚乙酯的反应为:
。用环氧乙烷合成碳酸亚乙酯的反应为:![]() 。下列说法错误的是
。下列说法错误的是
A.上述反应属于加成反应
B.碳酸亚乙酯的二氯代物只有两种
C.碳酸亚乙酯中的所有原子处于同一平面内
D.1mol碳酸亚乙酯最多可消耗2molNaOH
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。用0.1 mol·L-1NaOH溶液滴定20mL 0.1mol·L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH)。下列说法正确的是
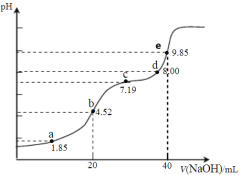
A.b点所得溶液中:c(H+)+c(SO32-)=c(OH-)+c(H2SO3)
B.a点所得溶液中:2c(HSO3-)+c(SO32-)=0.1mol·L-1
C.e点所得溶液中:c(Na+)> c(SO32-)> c(H+)> c(OH-)
D.c点所得溶液中:c(Na+)>3c(HSO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构中每个原子均满足8电子结构。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法中错误的是( )
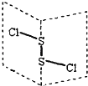
A. S2Cl2中的硫元素显+1价
B. S2Cl2中含极性键和非极性键,是非极性分子
C. S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D. S2Cl2与H2O反应的生成物中可能有S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、R、X、Y、Z五种元素的原子序数依次递增。
已知:①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布为msnmpn;
③Q、X原子p能级的电子数分别为2和4。请回答下列问题:
(1)Z2+的核外电子排布式是___;基态Q原子的价电子排布图为_____。
(2)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是____(填字母)。
a.稳定性:甲>乙 b.沸点:甲<乙
(3)Q、R、X三种元素的第一电离能数值由小至大的顺序为_____(用元素符号作答)。
(4)五种元素中,电负性最大的非金属元素是___,电负性最小的非金属元素是___。(用元素符号作答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的某磁黄铁矿(主要成分FexS,S为-2价)与100mL盐酸恰好完全反应(矿石中其他成分不与盐酸反应),生成3.2g硫单质、0.4molFeCl2和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是( )
A.该盐酸的物质的量浓度为4.0mol·L-1
B.该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为2:1
C.生成的H2S气体在标准状况下的体积为8.96L
D.该磁黄铁矿中FexS的x=0.85
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】425℃时,在两个1L密闭容器中分别发生化学反应,物质的浓度随时间的变化如图所示。下列叙述错误的是( )
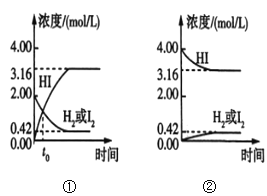
A.图①中t0时,三种物质的物质的量相等
B.图①中t0时,反应未达到平衡状态
C.图①②中,当c(HI)=3.16mol/L时,两容器中的反应均达到平衡状态
D.混合气体的密度不再发生变化可以作为达到平衡状态的标志
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下一系列反应,最终产物是乙二酸。
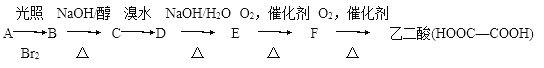
试回答下列问题:
(1)C的结构简式是________。B―→C的反应类型是________。
(2)E―→F的化学方程式是__________
(3)E与乙二酸发生酯化反应生成环状化合物的化学方程式是___________。
(4)由B发生水解反应或C与H2O发生加成反应均生成化合物G。在乙二酸、水、苯酚、G四种分子中,羟基上氢原子的活泼性由强到弱的顺序是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A、B、C、D和E的结构简式如下:

请回答下列问题:
(1)指出反应的类型:A→B_______;A→D_______。
(2)在A~E五种物质中,互为同分异构体的是_______;所有的原子有可能都在同一平面的物质是_______。(填序号)
(3)写出由A生成C的化学方程式:_______。
(4)写出D与NaOH溶液共热反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是制备和收集气体的实验装置,该装置不能用于( )
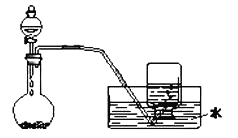
A.Zn与稀硫酸制H2B.稀硝酸与铜反应制取一氧化氮
C.双氧水制取氧气D.用Cu和浓硫酸制取SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com