
| A. | +6 | B. | +5 | C. | +4 | D. | +3 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
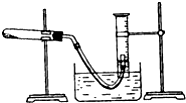 某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量.实验步骤如下:
某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量.实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图甲表示使用催化剂后,该反应的△H变小 | |
| B. | 图乙表示反应NO(g)+CO(g)?$\frac{1}{2}$N2(g)+CO2(g)△H=-373.4kJ•mol-1反应的平衡常数随温度的变化 | |
| C. | 图丙表示反应H2(g)+I2(g)?2HI(g)中H2的转化率随压强的变化 | |
| D. | 图丁表示在饱和Na2SO4溶液中逐步加BaCO3固体后,溶液中c(${SO}_{4}^{2-}$)的浓度变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制备硝基苯加入试剂的顺序为:先加入浓硫酸,再滴加苯,最后滴加浓硝酸 | |
| B. | 蔗糖和葡萄糖不是同分异构体,但属同系物 | |
| C. | 可用金属钠区分乙酸、乙醇和苯 | |
| D. | 石油裂解和煤的干馏都是化学变化,而石油的分馏和煤的气化都是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
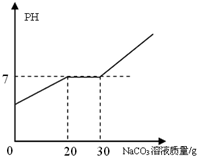 向21.88g 含有少量氯化钙的稀盐酸中加入10.6%的碳酸钠溶液,所加入的碳酸钠溶液质量和溶液PH的关系如图所示.
向21.88g 含有少量氯化钙的稀盐酸中加入10.6%的碳酸钠溶液,所加入的碳酸钠溶液质量和溶液PH的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0.1NA | |
| B. | 10g46%的乙醇水溶液中所含氢原子数目为0.06NA | |
| C. | 1L1 mol•L-1的NH4NO3溶液中含有NH4+数目为NA | |
| D. | 25℃时,100mlpH=13的Ba(OH)2溶液中OH-的数目为0.01NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
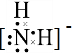 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com