
【题目】工业上常用PCl5作为制造乙酰纤维素的催化剂,也常用于手性药品的研发,在材料,医药工业得到了广泛应用,请回答下列问题:
(1)PCl5在固态是离子化合物,相对式量为417,其阳离子为![]() ,则阴离子的化学式为_______。
,则阴离子的化学式为_______。
(2)已知: P(s) + ![]() Cl2(g) = PCl3(g) H= -306 KJ/mol
Cl2(g) = PCl3(g) H= -306 KJ/mol
PCl5(g) = PCl3(g) + Cl2(g) H= + 93 KJ/mol
则反应2P(s) + 5Cl2(g) = 2PCl5(g)的H=______kJ/mol。
(3)温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,容器中发生反应:PCl5(g)PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
t/min | 0 | 10 | 20 | 30 | 40 |
n(PCl3)/mol | 0 | 0.12 | 0.17 | 0.2 | 0.2 |
①反应在前10min的平均速率v(PCl5)=_______;
②不能表明该反应达到平衡状态的是:____ (选填序号);
a.容器的总压强不再改变
b.混合气体的平均相对分子质量不变
c.v正(PCl3)等于v逆(Cl2)
d.混合气体的密度不变
e.PCl5的质量不再变化
③要提高上述反应的转化率,可采取的措施有(至少两种)___________;
④该温度下,反应PCl5(g)PCl3(g) + Cl2(g)的平衡常数Kp=2.25×105(Kp为压强平衡常数,Kp=![]() )。把一定量的PCl5引入一真空瓶内,达平衡后PCl5的分压为2.5×104Pa,则PCl5的分解率为________。
)。把一定量的PCl5引入一真空瓶内,达平衡后PCl5的分压为2.5×104Pa,则PCl5的分解率为________。
(4)在热水中,五氯化磷完全水解,生成磷酸和盐酸。若将0.01molPCl5投入热水中配成lL溶液,再逐滴加入AgNO3溶液,先产生的沉淀是_____。 [已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10]。
【答案】![]() -798 0.006mol·L-1·min-1 d 可以升高温度,减小压强,移走氯气、三氯化磷等 75% AgCl
-798 0.006mol·L-1·min-1 d 可以升高温度,减小压强,移走氯气、三氯化磷等 75% AgCl
【解析】
计算PCl5固体中阴离子的化学式时,可利用相对分子质量确定分子式,再减去阳离子的化学式;利用盖斯定律,可计算待求热化学反应的H;计算反应在前10min的平均速率v(PCl5)时,可先求出v(PCl3),然后利用化学计量数进行转换;判断某量不变是否为平衡状态时,需判断该量是否为变量,变量不变是平衡状态;提高转化率的措施可以是改变温度、压强、浓度等;求PCl5分解率时,可假设起始量与变化量,建立三段式,利用压强平衡常数先求出
PCl3的平衡量,再求出变化量,最后求转化率;判断先生成的沉淀为Ag3PO4还是AgCl时,可利用Ksp求出两种平衡体系中的c(Ag+),数值小的先生成沉淀。
(1)PCl5的相对分子质量为208.5,则相对式量为417时的化学式为P2Cl10;其阳离子为![]() ,则阴离子的化学式为P2Cl10-
,则阴离子的化学式为P2Cl10-![]() =
=![]() 。答案为:
。答案为:![]() ;
;
(2) P(s) + ![]() Cl2(g) = PCl3(g) H= -306 KJ/mol ①
Cl2(g) = PCl3(g) H= -306 KJ/mol ①
PCl5(g) = PCl3(g) + Cl2(g) H= + 93 KJ/mol ②
利用盖斯定律,将(①-②)×2,便可得出反应2P(s) + 5Cl2(g) = 2PCl5(g)的H=-(306+93)×2kJ/mol= -798 kJ/mol。答案为:-798;
(3)①反应在前10min的平均速率v(PCl5)= v(PCl3)= = 0.006mol·L-1·min-1;
= 0.006mol·L-1·min-1;
②a.因为反应前后气体的分子数不等,所以容器的总压强不再改变时,反应达平衡状态,a不合题意;
b.因为反应前后气体的分子数不等,平衡前混合气体的平衡相对分子质量始终发生改变,所以当混合气体的平均相对分子质量不变时,反应达平衡状态,b不合题意;
c.v正(PCl3)等于v逆(Cl2),满足反应进行方向相反,速率之比等于化学计量数之比,所以反应达平衡状态,c不合题意;
d.因为混合气体的总质量不变,体积不变,所以混合气体的密度始终不变,混合气体密度不变时,反应不一定达平衡状态,d符合题意;
e.只要平衡发生移动,PCl5的质量就发生改变,所以当PCl5的质量不变时,反应达平衡状态,e不合题意;
故选d;
③因为反应为吸热的、分子数增大的可逆反应,所以要提高上述反应的转化率,可采取的措施有:可以升高温度,减小压强,移走氯气、三氯化磷等;
④设PCl5(g)的起始投入量为1mol,参加反应的物质的量为x,其三段式为:
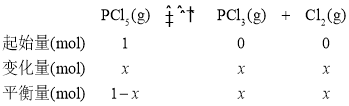
Kp=![]() =2.25×105,p(PCl3)=7.5×104,
=2.25×105,p(PCl3)=7.5×104,![]() ,x=0.75mol,则PCl5的分解率为
,x=0.75mol,则PCl5的分解率为![]() =75%。
=75%。
答案为:0.006mol·L-1·min-1;d;可以升高温度,减小压强,移走氯气、三氯化磷等;75%。
(4)若将0.01molPCl5投入热水中配成lL溶液,则溶液中c(Cl-)=0.05mol/L,c(H3PO4)=0.01mol/L,c(![]() )<0.01mol/L,当Cl-沉淀时,所需c(Ag+)=
)<0.01mol/L,当Cl-沉淀时,所需c(Ag+)=![]() mol/L=3.6×10-9mol/L;当
mol/L=3.6×10-9mol/L;当![]() 生成沉淀时,所需c(Ag+)=
生成沉淀时,所需c(Ag+)=![]() mol/L>1.1×10-6mol/L。因为1.1×10-6>3.6×10-9,所以先产生的沉淀是AgCl。答案为:AgCl。
mol/L>1.1×10-6mol/L。因为1.1×10-6>3.6×10-9,所以先产生的沉淀是AgCl。答案为:AgCl。


科目:高中化学 来源: 题型:
【题目】硫脲(![]() )是一种白色而有光泽的晶体,味苦,可用于制造树脂,也用作橡胶的硫化促进剂以及金属矿物的浮选剂等。回答下列问题:
)是一种白色而有光泽的晶体,味苦,可用于制造树脂,也用作橡胶的硫化促进剂以及金属矿物的浮选剂等。回答下列问题:
(1)硫脲中硫的化合价为_______;与硫脲互为同分异构且能与FeCl3溶液发生显色反应的化合物的化学式为_______
(2)可用H2NCN(氨基腈)与C2H5SH (乙硫醇)反应制备硫脲。氨基腈的电子式为_____
(3)制取氨基腈的传统工艺流程如下:

①反应Ⅱ的化学方程式为______
②测定硫脲含量的方法如下:
步骤1 :准确称取a g产品,经溶解等步骤最后在500 mL容量瓶中定容。
步骤2:准确量取20.00 mL配制好的溶液注入碘量瓶中,加入V1 mL c1 mol/L I2的标
准溶液及适量的NaOH溶液,于暗处放置10 min(2NaOH+I2=NaIO+NaI+H2O,
4NaIO+(NH2)2CS+H2O =(NH2)2CO+4NaI+H2SO2)。
步骤3:加水及适量的盐酸,摇匀。
步骤4:用c2 mol/L标准Na2S2O2溶液滴定剩余的I2( I2+2Na2S2O2=2NaI+Na2S4O6) ,加入淀粉溶液,滴定至终点时消耗Na2S2O2溶液V2mL。
“步骤3”加入盐酸的目的_________(用离子方程式说明)。
“步骤4”滴定至终点时的颜色变化是________。
③产品中(NH2)2CS的质量分数为_______ (列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.1molCH3COONa和0.05molHCl溶于水配成1L溶液(pH<7)。
(1)用离子方程式表示该溶液中存在的三个平衡体系___、___、__。
(2)溶液中各离子的物质的量浓度由大到小顺序为___。
(3)溶液中粒子中浓度为0.1mol/L的是___,浓度为0.05mol/L的是__。
(4)物质的量之和为0.lmol的两种粒子是___与___。
查看答案和解析>>
科目:高中化学 来源: 题型:
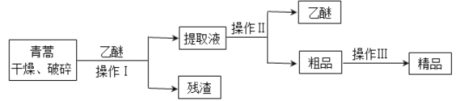
【题目】青蒿素,是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:
请回答下列问题:
(1)对青蒿进行干燥、破碎的目的是_______。
(2)操作I需要的玻璃仪器主要有:烧杯、漏斗、______,操作Ⅱ的名称是_____。
(3)操作Ⅲ的主要过程可能是_______(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)某学生对青蒿素的性质进行探究:将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与_____(填字母)具有相同的性质。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
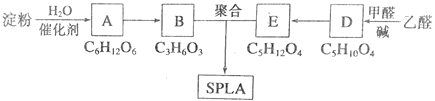
【题目】星型聚合物SPLA可经下列反应路线得到(部分反应条件未注明)。
已知:SPLA的结构简式为: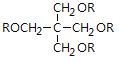 ,其中R为
,其中R为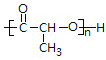 。
。
(1)淀粉是___糖(填“单”或“多”);A的名称是___。
(2)生成D的化学反应类型属于___反应;D结构中有3个相同的基团,且1 mol D能与2 mol Ag(NH3)2OH溶液反应,则D的结构简式是___;D→E反应的化学方程式为___。
(3)B的直链同分异构体G的分子中不含甲基,G既不能与NaHCO3溶液反应,又不能与新制Cu(OH)2悬浊液反应,且1mol G与足量Na反应生成1 mol H2,则G的结构简式为___。
(4)B有多种脱水产物,其中两种产物的结构简式为______和______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3p轨道全充满。A+比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C、D的电负性由小到大的顺序为________________。
(2)C的最高价氧化物分子是________(填“极性”或“非极性”)分子。
(3)与B同主族元素X,其气态氢化物是同主族元素的氢化物中沸点最高的,解释X的气态氢化物极易溶于水的原因:①_______________②_______________
(4)E的一种常见配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断E(CO)5的晶体类型为____;E(CO)5在一定条件下发生分解反应:E(CO)5===E(s)+5CO,反应过程中,断裂的化学键只有配位键,形成的化学键是________________。
(5)金属E单质的晶体在不同温度下有两种堆积方式,晶胞如图所示。
体心立方晶胞和面心立方晶胞中E原子的配位数之比为________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒(23V)是我国的丰产元素,广泛用于催化及钢铁工业。回答下列问题:
(1)钒在元素周期表中的位置为_______,其价层电子排布图为____________。
(2)钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为____、_____。
(3)V2O5常用作SO2转化为SO3的催化剂。SO2分子中S原子价层电子对数是__对,分子的立体构型为___;SO3气态为单分子,该分子中S原子的杂化轨道类型为____;SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为___;该结构中S—O键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为__(填图2中字母),该分子中含有___个σ键。
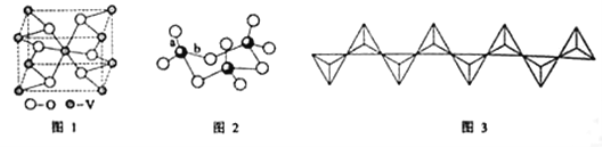
(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为___;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着我国汽车年销量的大幅增加,给空气环境造成了很大的污染。汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )

A. 反应中NO为氧化剂,N2为氧化产物
B. 汽车尾气的主要污染成分包括CO、NO和N2
C. NO和O2必须在催化剂表面才能反应
D. 催化转化总化学方程式为2NO+O2+4CO ![]() 4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】动手实践:某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
实验步骤 | 实验现象 |
①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
②向新制得的Na2S溶液中满加新制的氯水 | B.有气体产生,溶液变成浅红色 |
③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体 |
⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉锭 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究____________元素性质递变规律。
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlC13溶液,NaOH溶液,酚酞溶液等。仪器:①__________,②__________,试管,试管夹,胶头滴管,镊子,小刀,玻璃片,砂纸,火柴等。
(3)实验内容:(填写与实验步骤对应实验现象的编号和②的化学方程式及此实验的结论)__________
实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
实验现象(填A~F) |
①_____________________________________,
②_____________________________________,
此实验的结论:_______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com