
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| 实验编号 | 盐酸体积( mL ) | 标准NaOH溶液的体积(mL) |
| 1 | 20.00 | 18.20 |
| 2 | 17.10 | |
| 3 | 16.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(一)(1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在下表中填空,表示称量过程,并在图3—2所示的游码尺上画出游码的位置(画“|”表示)。
| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 取用砝码情况 |
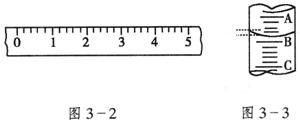
(2)图3—3表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量筒中的液体的体积是__________mL。
(3)配制![]() 的硫酸溶液200mL所需的玻璃仪器为___________。
的硫酸溶液200mL所需的玻璃仪器为___________。
(二)随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精确度也越来越高。现有一种简单可行的测定的方法,具体步骤为:
(1)将固体NaCl细粒干燥后,准确称取mg NaCl固体并转移到定容仪器A中;
(2)用滴定管向A仪器中加苯,不断振荡,继续加苯至A仪器的刻度,计算出NaCl固体的体积![]() 。
。
请回答下列问题:
①步骤(1)中A仪器最好使用___________。(填序号)
A.量筒 B.烧杯 C.容量瓶 D.试管
②步骤(2)中用酸式滴定管还是用碱式滴定管______________,理由是_____________。
③能否用水代替苯__________,理由是____________。
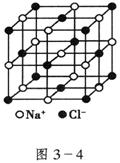
④已知NaCl晶体中,靠得最近的![]() 与
与![]() 间的平均距离为a cm(如图3—4),用上述测定方法测得的阿伏加德罗常数
间的平均距离为a cm(如图3—4),用上述测定方法测得的阿伏加德罗常数![]() 的表达式为_______________。
的表达式为_______________。
(三)在配制物质的量浓度溶液时,下列操作出现的后果是(填:“溶液浓度不准确”、“偏低”、“偏高”、“无影响”):
(1)配制氢氧化钠溶液时,称取已吸潮的氢氧化钠固体。_____________。
(2)配制氢氧化钠溶液时,溶液不能澄清,溶质少量不溶解。____________。
(3)配制氯化钠溶液时,容量瓶中有少量水。______________。
(4)定容时,液面上方与刻度相齐时,停止加水。__________。
(5)配制好溶液后,容量瓶未塞好,洒出一些溶液。_____________。
(6)发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度线________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年吉林长春实验中学高一上学期第一次月考化学试卷(带解析) 题型:填空题
(每空2分共12分)在配制物质的量浓度溶液时,下列操作出现的后果是(填“偏低”“偏高”“无影响”):
(1)配制氢氧化钠溶液时,称取已吸潮的氢氧化钠固体________________
(2)配制氢氧化钠溶液时,未冷却至室温就转移入容量瓶并定容_____________
(3)配制氢氧化钠溶液时,未洗涤小烧杯和玻璃棒______________
(4)配制氢氧化钠溶液时,容量瓶内残留少量水_____________
(5)配制氢氧化钠溶液时,定容时俯视刻度线______________
(6)配制氢氧化钠溶液时,定容时发现液面超过刻度线,立即用吸管吸出少量水,使液面降至刻度线_______________
查看答案和解析>>
科目:高中化学 来源:2011-2012年度上海市吴淞中学高二第一学期期末考试化学试卷 题型:实验题
(一)在配制物体的量浓度溶液时,下列操作出现的后果是(填: “偏低”、“偏高”、“无影响”):
(1)配制氢氧化钠溶液时,称取已吸潮的氢氧化钠固体 。
(2)配制氯化钠溶液时,容量瓶中有少量水。 。
(3)发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度线。 。
(二)实验室常用标准NaOH溶液测定未知盐酸溶液的浓度。
(1)配制0.5mol·L-1NaOH溶液250mL所需的玻璃仪器为 。
(2)用滴定管准确量取20.00毫升未知浓度盐酸于锥形瓶中,加入酚酞作指示剂,用NaOH溶液滴定到终点。
某学生进行了三次实验,实验数据如下表:
| 实验编号 | 盐酸体积( mL ) | 标准NaOH溶液的体积(mL) |
| 1 | 20.00 | 18.20 |
| 2 | 17.10 | |
| 3 | 16.90 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com