


科目:高中化学 来源: 题型:
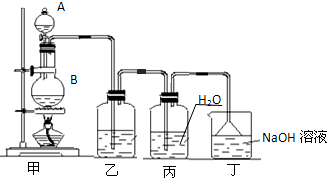
 (2011?松江区模拟)为了制得氯气并探究氯气的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中.试回答:
(2011?松江区模拟)为了制得氯气并探究氯气的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中.试回答:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:058
(1)实验室常用二氧化锰和浓盐酸反应制取氯气,反应方程式是________.
(2)高锰酸钾 在酸性条件下有很强的氧化性,它在常温下就能将
在酸性条件下有很强的氧化性,它在常温下就能将 氧化为
氧化为 ,
, 被还原成
被还原成 ,写出高锰酸钾跟浓盐酸在室温下反应制取氯气的化学方程式______________________________.
,写出高锰酸钾跟浓盐酸在室温下反应制取氯气的化学方程式______________________________.
(3)历史上曾用“地康法”制氯气.这一方法用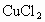 作催化剂,在450℃利用空气中的氧气跟氯化氢反应制氯气.反应的化学方程式是_______
作催化剂,在450℃利用空气中的氧气跟氯化氢反应制氯气.反应的化学方程式是_______
__________________.
(4)从氯元素化合价变化看,以上三种方法的共同点是________________.
(5)比较以上三个反应,可认为氧化剂的氧化能力从强到弱的顺序为_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
①二氧化锰;②碱石灰;③大理石;④氯化钠;⑤双氧水;⑥浓氨水;⑦浓盐酸;⑧蒸馏水。
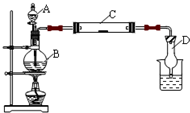
请根据如图所示的实验装置结合实验原理回答下列问题。

(1)请在下表中填入利用该装置可以制取的气体和所需药品的编号(表格可以不填全)。
可以制取的气体(填化学式) | 所需药品的编号 |
|
|
|
|
|
|
|
|
(2)请简述检查该装置气密性的正确实验操作。
(3)资料显示:“氨气可在纯氧中安静燃烧……”某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去),进行氨气与氧气在不同条件下反应的实验。

①将产生的氨气与过量的氧气通到装置A(催化剂为铂石棉)中,用酒精喷灯加热。请写出氨催化氧化的化学方程式是______________________________________;
②将过量的氧气与氨气分别从B装置中a、b两管进气口通入到装置B中,并在b管上端点燃氨气。则两气体通入的先后顺序是___________________________________________,理由是________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:江苏期末题 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:
(2)高锰酸钾(KMnO4)在酸性条件下有很强的氧化性,它在常温下就能将Cl-氧化为Cl2,![]() 被还原成Mn2+,写出高锰酸钾跟浓盐酸在室温下反应制取氯气的化学方程式______________________________。
被还原成Mn2+,写出高锰酸钾跟浓盐酸在室温下反应制取氯气的化学方程式______________________________。
(3)历史上曾用“地康法”制氯气。这一方法用CuCl2作催化剂,在
(4)从氯元素化合价变化看,以上三种方法的共同点是______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com