
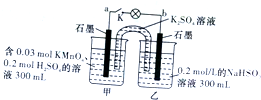
| A. | 电池工作时,甲烧杯中由烧杯中由水电离出的c(H+)逐渐减小 | |
| B. | 电池工作时,盐桥中的“K+”移向甲烧杯,外电路的方向是从b到a | |
| C. | 当电路中有1.204×1021个电子转移时,乙烧杯中溶液的pH约为2 | |
| D. | 乙池中的氧化产物为SO${\;}_{4}^{2-}$ |
分析 图中装置为原电池,反应中高锰酸钾被还原,在酸性条件下生成Mn2+,甲中电极为原电池的正极,乙中亚硫酸钠被氧化,为原电池的负极,被氧化生成SO42-,结合电极方程式解答该题.
解答 解;A.电池工作时,甲烧杯中电极方程式为2MnO4-+16H++10e-=2Mn2++8H2O,反应消耗H+,硫酸浓度降低,则水电离出的c(H+)逐渐增大,故A错误;
B.甲为正极,电池工作时,阳离子移向正极,盐桥中的K+移向甲烧杯,外电路的电子方向是从b(负极)到a(正极),故B正确;
C.乙中电极反应为HSO3--2e-+H2O=SO42-+3H+,则当电路中有1.204×1021个电子转移时,即0.002mol电子转移时,乙中生成0.003molH+,c(H+)=$\frac{0.003mol}{0.3L}$=0.01mol/L,则pH=2,故C正确;
D.乙中电极反应为HSO3--2e-+H2O=SO42-+3H+,氧化产物为SO42-,故D正确.
故选A.
点评 本题综合考查原电池知识,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握电极方程式的书写,为解答该题的关键,题目难度中等.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 | |
| B. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O | |
| C. | NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32- | |
| D. | FeCl3溶液腐蚀印刷电路:Fe3++Cu=Fe2++Cu2+? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入稀氨水,水的电离平衡逆向移动,c(OH-)减小 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 | |
| C. | 向水中加入少量固体CH3COO Na,水的电离平衡逆向移动,c(H+)减小 | |
| D. | 将水加热,KW增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
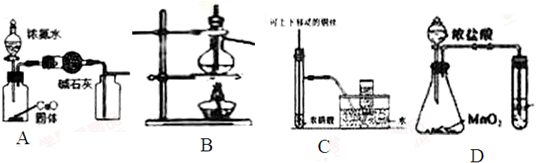
| A. | 制取并收集干燥纯净的NH3 | B. | 分离Br2和CCl4的混合物 | ||
| C. | 用于制备并收集少量NO | D. | 比较MnO2、Cl2、S 的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | S(g)+O2(g)=SO2(g)放热为Q′,则Q′>Q | |
| B. | S(g)+O2(g)=SO2(g)放热为Q′,则Q′<Q | |
| C. | 1mol SO2(g)的能量>1mol S(s)的能量+1mol O2(g)的能量 | |
| D. | 1mol SO2(g)的能量<1mol S(s)的能量+1mol O2(g)的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com