
【题目】25 ℃时,部分物质的电离常数如表所示:
化学式 | CH3COOH | H2CO3 |
电离常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 |
请回答下列问题:
(1)相同pH的CH3COONa、NaHCO3、Na2CO3浓度由大到小的顺序为__________
(2)常温下0.1mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母,下同)。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(H+)/c(OH-)
(3)现有10mLpH=2的盐酸溶液,进行以下操作:
a.与pH=5的盐酸等体积混合,则pH=_____________;
b.向该盐酸溶液中加入10mL0.02mol/LCH3COONa溶液,则该混合溶液中存在的物料守恒式为__________________;
c.向该盐酸溶液中加入等体积等浓度的Na2CO3溶液,则混合溶液中存在的电荷守恒式为_______________________;
d. 下列关于体积都为10mL,pH=2的A(盐酸)和B(CH3COOH)溶液说法正确的是_____ (填写序号)。
①与等量的锌反应开始反应时的速率A=B
②与等量的锌反应(锌完全溶解,没有剩余)所需要的时间A>B
③加水稀释100倍,pH大小比较:4=A>B>2
④物质的量浓度大小比较:A>B
⑤分别与10mLpH=12的NaOH溶液充分反应后的溶液pH大小比较:A<B
e. 现用标准HCl溶液滴定氨水,应选用________指示剂,下列操作会导致测定结果偏高的是___。
A.未用HCl标准溶液润洗滴定管
B.滴定前锥形瓶内有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.观察读数时,滴定前仰视,滴定后俯视
【答案】CH3COONa>NaHCO3>Na2CO3 AD 2.3 c(Na+)=c(CH3COO-)+c(CH3COOH) c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-) ①②③ 甲基橙 AC
【解析】
(1)三种溶液水解都显示碱性,pH相同时,酸根离子对应的酸性越强,盐溶液的浓度越大;
(2)CH3COOH溶液加水稀释过程中,醋酸的电离程度增大,氢离子浓度、醋酸根离子浓度减小,但氢氧根离子浓度增大;由于温度不变,则电离平衡常数、水的离子积不变,据此分析偏大;
(3)a.pH不同的强酸等体积混合时,混合溶液中pH=pH(小)+0.3;
b.根据CH3COONa书写物料守恒式;
c.向该盐酸溶液中加入等体积等浓度的Na2CO3溶液,溶液中存在的离子有:Na+、H+、OH-、HCO3-、CO32-、Cl-,据此书写电荷守恒式;
d. 体积都为10mL,pH=2的A(盐酸)和B(CH3COOH)溶液中c(H+)相等,CH3COOH的物质的量大于盐酸,据此分析判断;
e. 用标准HCl溶液滴定氨水,滴定终点时溶液显酸性,应选用甲基橙作指示剂。分析判断各操作中盐酸体积的变化,再根据c(氨水)=![]() 分析判断。
分析判断。
(1) 由于酸根离子部分水解,四种溶液都呈碱性,pH相同时,酸根离子对应的酸的酸性越强,其水解程度越弱,若使pH相同,则其盐溶液的浓度越大,由于酸性CH3COOH>H2CO3>HCO3-,因此相同pH的CH3COONa、NaHCO3、Na2CO3浓度由大到小的顺序为CH3COONa>NaHCO3>Na2CO3
(2)A.0.1molL-1的CH3COOH溶液加稀释过程中,溶液中氢离子浓度减小,故A正确;B.0.1molL-1的CH3COOH溶液加水稀释过程中,各个微粒浓度减小,同时醋酸的电离向右移动,c(H+)减小的程度小于c(CH3COOH)的减小程度,则c(H+)/c(CH3COOH)增大,故B错误;C.Kw=c(H+)c(OH-)只受温度的影响,温度不变则其值是一个常数,故C错误;D.0.1molL-1的CH3COOH溶液加稀释过程中,溶液中c(H+)减小,c(OH-)增大,因此c(H+)/c(OH-)减小,故D正确;故答案为:AD;
(3) 10mLpH=2的盐酸溶液中含有0.01L×0.01mol/L=0.0001molHCl。
a.pH不同的强酸等体积混合时,混合溶液中pH=pH(小)+0.3,所以混合溶液中pH=2+0.3=2.3,故答案为:2.3;
b.向该盐酸溶液中加入10mL0.02mol/LCH3COONa溶液,反应后的溶液中含有等物质的量的CH3COONa、CH3COOH和NaCl,溶液中存在的物料守恒式为c(Na+)=c(CH3COO-)+c(CH3COOH),故答案为:c(Na+)=c(CH3COO-)+c(CH3COOH);
c.向该盐酸溶液中加入等体积等浓度的Na2CO3溶液,溶液中存在的离子有:Na+、H+、OH-、HCO3-、CO32-、Cl-,则混合溶液中存在的电荷守恒式为c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),故答案为:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-);
d. 体积都为10mL,pH=2的A(盐酸)和B(CH3COOH)溶液中c(H+)相等,CH3COOH的物质的量大于盐酸。①c(H+)相等,与等量的锌反应开始反应时的速率A=B,故①正确;②反应过程中醋酸会继续电离,使得c(H+)大于盐酸,反应速率醋酸大于盐酸,与等量的锌反应所需要的时间A>B,故②正确;③加水稀释100倍,醋酸继续电离,c(H+)大于盐酸,pH:4=A>B>2,故③正确;④CH3COOH的物质的量大于盐酸,物质的量浓度大小比较:A<B,故④错误;⑤分别与10mLpH=12的NaOH溶液充分反应后,醋酸过量,溶液显酸性,而盐酸与氢氧化钠恰好反应,溶液显中性,反应后的溶液pH大小比较:A>B,故⑤错误;正确的有①②③,故答案为:①②③;
e. 用标准HCl溶液滴定氨水,滴定终点时溶液显酸性,应选用甲基橙作指示剂。A.未用HCl标准溶液润洗滴定管,导致盐酸浓度偏低,滴定消耗的盐酸体积偏大,则测定结果偏高,正确;B.滴定前锥形瓶内有少量水,不影响滴定结果,错误;C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失,导致消耗的盐酸体积偏大,则测定结果偏高,正确;D.观察读数时,滴定前仰视,滴定后俯视,导致消耗的盐酸体积偏小,则测定结果偏低,错误;导致测定结果偏高有AC,故答案为:甲基橙;AC。


科目:高中化学 来源: 题型:
【题目】标出下列氧化还原反应中电子转移的方向和数目____________
![]()
该反应的还原产物是______________;____________元素被氧化;若反应有![]() 电子发生转移,则被还原的氧化剂是_________mol。
电子发生转移,则被还原的氧化剂是_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题:
(1)二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体转化为二氧化碳和水,达到无害化.有关甲醛、苯、二氧化碳及水说法正确的是_____。
①苯与B3N3H6的总电子数相等;
②甲醛、苯分子中碳原子均采用sp3杂化;
③苯、二氧化碳、水和甲醛都是非极性分子;
④水的沸点比甲醛高得多,是因为水分子间能存在氢键,甲醛分子间不存在氢键。
(2)2007年诺贝尔物理学奖为法国科学家阿尔贝费尔和德国科学家彼得格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就.某钙钛型复合氧化物(如图1),以A原子为晶胞的顶点,A位可以是Ca,Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应。
①用A,B,O表示这类特殊晶体的化学式:_______ 。
②Cr、Mn的核外特征电子排布式分别为:Cr:[Ar]3d54s1、Mn:[Ar]3d54s2,则它们第一电离能由小到大的排列顺序是:_______用“<”排列)。
(3)CO2的空间构型为______;固体CO2与SiO2熔沸点差异很大的原因是________
(4)冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图2)类似,其中空心球所示原子位于立方体的顶点或面心,实心球所示原子位于立方体内)类似.每个冰晶胞平均占有__个水分子;冰晶胞与金刚石晶胞微粒排列方式相同的原因是_______ 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下0.1 mol/L的NaHB(强电解质)溶液中c(H+)>c(OH-),则下列关系一定正确的是( )
A. c(Na+)=c(HB-)+2c(B2-)+c(OH-)
B. c(Na+)=0.1 mol/L≥c(B2-)
C. HB-的水解方程式为HB-+H2O![]() B2-+H3O+
B2-+H3O+
D. 在该盐的溶液中,离子浓度大小顺序为c(Na+)>c(HB-)>c(B2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关物质的量浓度关系正确的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+) + c(M+)>c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-) +2c(OH-)=2c(H+) + c(CH3COOH)
D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷能形成众多单质与化合物。回答下列问题:
(1)磷在成键时,能将一个3s电子激发进入3d能级而参加成键,写出该激发态原子的核外电子排布式__ 。
(2)黑磷是一种二维材料,其中一层的结构如图1所示。
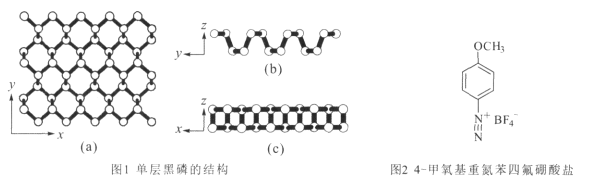
①黑磷中P原子的杂化方式为 _________ 。每一层内P形成六元环彼此相接,平均每个空间六元环中含有的磷原子是 ____个。
②用4-甲氧基重氮苯四氟硼酸盐(如图2)处理黑磷纳米材料,可以保护和控制其性质。
该盐的构成元素中C、N、O、F的电负性由大到小顺序为__,1mol该盐阳离子含有的σ键的数目为______ ,该盐阴离子的几何构型是__。
(3)磷钇矿可提取稀土元素钇(Y),某磷钇矿的结构如下:

该磷钇矿的化学式为__,与PO43—互为等电子体的阴离子有__ (写出两种离子的化学式)。已知晶胞参数a= 0.69 nm,c=0.60 nm,阿伏加德罗常数为NA,则该磷钇矿的密度为__g.cm—3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃复分解反应可示意如下:

利用上述方法制备核苷类抗病毒药物的重要原料W的合成路线如下:

回答下列问题:
(1)B的化学名称为____。
(2)由B到C的反应类型为____。
(3)D到E的反应方程式为____。
(4)化合物F在Grubbs II催化剂的作用下生成G和另一种烯烃,该烯烃的结构简式是____。
(5)H中官能团的名称是 ______.
(6)化合物X是H的同分异构体,可与FeCl3溶液发生显色反应,1mol X最多可与3mol NaOH反应,其核磁共振氢谱为四组峰,峰面积比为3:2:2:1。写出两种符合要求的X的结构简式:_____。
(7)由![]() 为起始原料制备
为起始原料制备 的合成路线如下,请补充完整(无机试剂任选)。
的合成路线如下,请补充完整(无机试剂任选)。
 _________________。
_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛矿工业中的硫酸酸性废水富含Ti、Fe等元素,其综合利用如下:
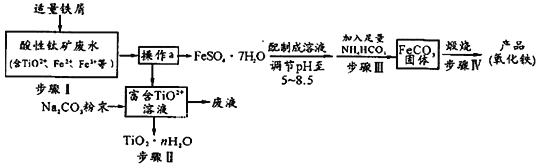
已知:TiO2+易水解,只能存在于强酸性溶液中。
(1)TiO2+钛的化合价为________________。
(2)步骤Ⅰ中加入铁屑的作用是________________________。(以离子方程式表示)
(3)操作a是_________ 、__________、过滤、洗涤、干燥 。
(4)步骤Ⅲ中发生反应的化学方程式为________________________;反应温度一般需控制在35℃以下,其目的是____________________________________。
(5)已知Ksp=[Fe(OH)2] = 8×10-16。步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5,所得的FeCO3中没有Fe(OH)2。则溶液中c(Fe2+)小于________ mol/L。步骤Ⅳ中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是___________。
(6)向“富含TiO2+溶液”中加入Na2CO3粉末易得到固体TiO2 nH2O。请结合平衡移动原理和化学用语解释其原因_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向H2C2O4溶液中滴加NaOH溶液,若pc=-lg c,则所得溶液中pc(H2C2O4)、pc(HC2O4-)、pc(C2O42-)与溶液pH的关系如图所示。下列说法正确的是

A. M点时, 2c(HC2O4-)+c(C2O42-) >c(Na+)
B. pH=x时,c(HC2O4-)<c(H2C2O4)=c(C2O42-)
C. 常温下,Ka2(H2C2O4)=10-1.3
D. ![]() 随pH的升高而减小
随pH的升高而减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com