
| ||
| ||
| ||
| ||
| 1 |
| 3 |
| 1 |
| 3 |
| 1 |
| 6 |
| 1 |
| 6 |
| 0.112L |
| 22.4L/mol |
| 0.02mol |
| 0.2L |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、1:2 | B、1:1 |
| C、1:4 | D、2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
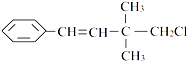 ( )
( )| A、一定条件下,能发生加聚反应 |
| B、能使溴水褪色 |
| C、一定条件下,能发生取代反应 |
| D、能与NaOH的醇溶液共热发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若满足:c(Cl-)=c(NH4+)>c(OH-)=c(H+),则溶质一定是NH4Cl |
| B、若满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶质一定是NH4Cl和NH3-?H2O |
| C、溶液中四种离子之间可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| D、若满足:c(NH4+)=c(Cl-),则溶液一定呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它们都是生活中常见的高分子化合物 |
| B、它们都是有机化合物 |
| C、它们在一定条件下都能发生水解反应 |
| D、它们都是生物体进行生命活动的能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:
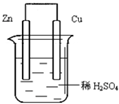
| A、铜片增重6.4g |
| B、锌片增重6.5 g |
| C、铜片上析出0.1 mol O2 |
| D、锌片溶解了6.5 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com