
����Ŀ��������ͼװ����ȡClO2 �� ����ClO2Ϊԭ���Ʊ��������ƣ�NaClO2��һ�ָ�Ч��������Ư��������֪��NaClO2������Һ���¶ȵ���38��ʱ�����ľ�����NaClO23H2O������38��ʱ����������NaClO2 �� ����60��ʱNaClO2�ֽ��NaClO3��NaCl�� 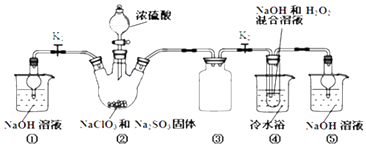
���������գ�
��1��װ�â��в���ClO2�Ļ�ѧ����ʽΪ��װ�â��з�����Ӧ�����ӷ���ʽΪ ��
��2��װ�â۵���������װ�âٺ͢��ڱ�ʵ���е����� ��
��3��װ�âܷ�Ӧ�����Һ�л���������NaOH���ʣ��Ӹ���Һ�����ˮNaClO2����IJ�������Ϊ���ټ�ѹ��55�����������ᾧ���ڳ��ȹ��ˣ�����50�����ҵ���ˮϴ�ӣ��ܵ���60�����õ���Ʒ�����������50�����ҵ���ˮϴ�ӵ�ԭ���� ��
��4���������ƴ��Ȳⶨ����ȷ��ȡ��������������Ʒ10.0g���ձ��У�������������ˮ�����ĵ⻯�ؾ��壬�ٵ���������ϡ���ᣬ��ַ�Ӧ�������û��Һ���250mL������Һ����ȡ25.00mL����Һ����2.0 molL��1Na2S2O3��Һ�ζ���I2+2S2O32��=2I��+S4O62�������Ե�����Һ��ָʾ�����ﵽ�ζ��յ�ʱ������Ϊ �� �ظ��ζ�3�Σ�������������ʾ�������Ʒ��NaClO2����������Ϊ ��
ʵ����� | �ζ�ǰ����/mL | �ζ������/mL |
1 | 0.00 | 19.96 |
2 | 3.26 | 23.30 |
3 | 1.10 | 23.40 |
��5��ʵ���������NaClO2���ʿɷֽ�ΪNaClO3��NaCl��ȡ������NaClO2 �� ����һ�ݼ��ȸ���60��ʹ֮���ʣ���һ���ϸ棬�������Һ�����ֱ�������FeSO4��Һ��Ӧʱ������Fe2+�����ʵ��������ͬ��������ͬ�������жϡ�����
���𰸡�
��1��2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O��2ClO2+H2O2+2OH��=2ClO2��+2H2O+O2��
��2����ֹ���������շ�Ӧ���������壬��ֹ����Ⱦ����
��3����ֹ����NaClO2?3H2O������¶ȹ��߲�Ʒ�ֽ�
��4��������һ�α�Һ����ƿ��Һ����ɫ��Ϊ��ɫ�Ұ�����ڲ���ɫ��90.5%
��5����ͬ
���������⣺��1�����ݷ�Ӧ��NaClO3��Na2SO3��H2SO4 �� ������ΪClO2��2Na2SO4 �� ��ƽ����ʽΪ��2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O��װ�âܷ�Ӧ���NaClO2 �� ��ӦΪ��2ClO2+H2O2+2OH��=2ClO2��+2H2O+O2�������Դ��ǣ�2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O��2ClO2+H2O2+2OH��=2ClO2��+2H2O+O2������2��װ�â�Ϊ��ȫƿ����ֹװ�â��������¶Ƚ��Ͷ�����������װ�âٺ͢����շ�Ӧ���������壬��ֹ����Ⱦ���������Դ��ǣ���ֹ���������շ�Ӧ���������壬��ֹ����Ⱦ��������3����ΪNaClO2������Һ���¶ȵ���38��ʱ�����ľ�����NaClO23H2O������38��ʱ����������NaClO2 �� ����60��ʱNaClO2�ֽ��NaClO3��NaCl����Ҫ�õ�NaClO2���壬����38��60��õ����壬��38��60�����ˮϴ�ӣ���ֹ����NaClO23H2O������¶ȹ��߲�Ʒ�ֽ⣬���Դ��ǣ���ֹ����NaClO23H2O������¶ȹ��߲�Ʒ�ֽ⣻��4���ⵥ�ʲκ����ɵķ�Ӧ��һ����õ�����Һ��ָʾ�����÷�Ӧ��Na2S2O3��Һ�ζ��⣬�������һ��Na2S2O3��Һ���յ���Һ����ɫ��Ϊ��ɫ�Ұ�����ڲ���ɫ��3�β�����������������������Ƶ�����ǣ� ![]() =20.77mL��
=20.77mL��
����ʱһ���ҳ���ϵʽ���ɴ˽��м��㣬��ϵʽΪClO2������2I2����4S2O32��
n��ClO2����= ![]() n��S2O32����=
n��S2O32����= ![]() ��20.77��10��3��2.0��0.01mol,
��20.77��10��3��2.0��0.01mol,
m��NaClO2��=0.01��90.5=9.05g������õ���Ʒ��NaClO2����������= ![]() ��100%=90.5%�����Դ��ǣ��������һ��Na2S2O3��Һ����ɫ��Ϊ��ɫ�Ұ�����ڲ���ɫ��90.5%����5��NaClO2���ʿɷֽ�ΪNaClO3��NaCl��ClԪ�ش�+3�۱�Ϊ+5�ۺͩ�1�ۣ���ӦΪ3NaClO2=2NaClO3+NaCl��NaClO2����������FeSO4��Һ��Ӧ3ClO2��+12Fe2++6H2O=4Fe��OH��3��+3Cl��+8Fe3+ �� ���յõ�ClԪ����+3�۱�Ϊ��1�ۣ�����NaClO2����ǰ��ֱ���Fe2+��Ӧʱ�����վ��õ�����NaCl��ClԪ�ؾ���+3�۱�Ϊ��1�ۣ����ݵ����غ㣬���������еõ��ĵ��ӵ����ʵ�����ͬ������������������FeSO4�����ʵ�����ͬ�����Դ��ǣ���ͬ��
��100%=90.5%�����Դ��ǣ��������һ��Na2S2O3��Һ����ɫ��Ϊ��ɫ�Ұ�����ڲ���ɫ��90.5%����5��NaClO2���ʿɷֽ�ΪNaClO3��NaCl��ClԪ�ش�+3�۱�Ϊ+5�ۺͩ�1�ۣ���ӦΪ3NaClO2=2NaClO3+NaCl��NaClO2����������FeSO4��Һ��Ӧ3ClO2��+12Fe2++6H2O=4Fe��OH��3��+3Cl��+8Fe3+ �� ���յõ�ClԪ����+3�۱�Ϊ��1�ۣ�����NaClO2����ǰ��ֱ���Fe2+��Ӧʱ�����վ��õ�����NaCl��ClԪ�ؾ���+3�۱�Ϊ��1�ۣ����ݵ����غ㣬���������еõ��ĵ��ӵ����ʵ�����ͬ������������������FeSO4�����ʵ�����ͬ�����Դ��ǣ���ͬ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ijѧУʵ���Ҵӻ�ѧ�Լ��̵���ص�Ũ�����Լ���ǩ�ϵIJ������ݡ����ø�Ũ��������480 mL�� 1 mol/L��ϡ���ᡣ�ɹ�ѡ�õ������У�����ƿ���ձ��۲�������ҩ�ע���Ͳ

��ش��������⣺
��1����Ũ��������ʵ���Ũ��Ϊ____________ mol/L��
��2������ϡ����ʱ�����������в���Ҫ��������____________������ţ�����ȱ�ٵ�������______________________________ (��д��������)��
��3�������㣬����480mL��1mol/L��ϡ������Ҫ����Ͳ��ȡ����Ũ��������Ϊ______ mL����ȡŨ�������õ���Ͳ�Ĺ����________��
(�����й����ѡ�ã� 10 mL���� 25 mL���� 50 mL����100 mL)
��4���������Ƶ�ϡ������вⶨ��������Ũ�ȴ���1mol/L�����ƹ��������и�������������������ԭ����____________��
A������ʱ����������ƿ�̶��߽��ж���
B�����ձ��н�Ũ�������ϡ�ͺ�����ת������ƿ��
C��ת����Һʱ��������������Һ��������ƿ����
D������ƿ������ˮϴ�Ӻ�δ���������������ˮ
E������ҡ�Ⱥ���Һ����ڿ̶��ߣ��ټ�����ˮ���̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʵ����ͺ���Ԫ�صĻ��ϼ����о��������ʵ�������Ҫ�Ƕȡ��������ͼ���ش���������:
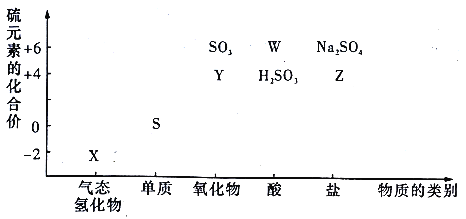
��1������Y���õ��Լ���_________��
��2��W��ϡ��Һ������Ӧ�����ӷ���ʽΪ_________��
��3�����Ʊ�Na2S2O3����������ԭ�Ƕȷ�������������_________(����)��
a.Na2S+S b.Na2SO3+S c.Na2SO3+Na2SO4 d.SO2+Na2SO4
��4����X��Y����Һ��ϣ�����Ϊ_________���÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������̬����ɵĻ������0.1mol��ȫȼ�յ�0.16Ħ��CO2��3.6gH2O,����˵����ȷ�ģ� ��
A. һ������ϩB. һ���Ǽ������ϩ
C. һ������ȲD. һ���м���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ù���NaOH�������ʵ���Ũ����Һʱ�����в����ᵼ����ҺŨ��ƫ�͵��ǣ�
A. ���ձ����ܽ�ʱ��������Һ�彦��
B. ��Ʒ�к�������Na2O����
C. ����ƿʹ��ǰ��NaOH��Һ��ϴ
D. ����ʱ��������ƿ�̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У����������ƶ�Cl-���ǣ�
A. KClO3��Һ B. Cl2 C. NaCl���� D. KCl��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ƚ�1mol������1molһ����̼������˵����ȷ���ǣ� ��
A. ������ͬB. ����������ͬ
C. ԭ��������ͬD. ��ԭ��������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ͼ���ʾ�������к���SiO2��Fe2O3��CeO2��FeO�����ʣ�ij����С���Դ˲�����ĩΪԭ�ϣ��Ƶ�Ce��OH��4��������立�������������£� 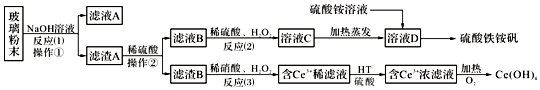
��֪�������������£�����ˮ��Һ����Ce3+��Ce4+������Ҫ������ʽ��Ce4+�н�ǿ�����ԣ�
��CeO2������ϡ���ᣬҲ����������������Һ��
�ش��������⣺
��1�������ٵ����������ò������õIJ��������У��ձ����� ��
��2����Ӧ��2���й�������������ǣ� ��
��3����Ӧ��3�������ӷ���ʽ�ǣ�
��4����֪�л���HT�ܽ�Ce3+��ˮ��Һ����ȡ�������ù��̿ɱ�ʾΪ��2Ce3+��ˮ�㣩+6HT���л��㣩2CeT3���л��㣩+6H+��ˮ�㣩��ƽ��ǶȽ��ͣ���CeT3���л��㣩���������ýϴ��ĺ�Ce3+��ˮ��Һ��ԭ���� ��
��5��������立��㷺����ˮ�ľ����������侻ˮԭ�������ӷ���ʽ��ʾΪ��
��6����ͬ���ʵ���Ũ�ȵ�����������Һ�У�笠�����Ũ���ɴ�С��˳���ǣ� ��
a��xFe2��SO4��3y��NH4��2SO4zH2Ob����NH4��2SO4c����NH4��2CO3d��NH3H2O
��7��Ϊ�ⶨij������立���Ʒ����ɣ��ֳ�ȡ14.00g����Ʒ����������ˮ���Ƴ�100mL��Һ���ٽ���Һ�ֳ����ȷݣ�������һ�ݼ�����������������Һ�����ˡ�ϴ�ӳ������ٺ�����������أ��õ�1.60g���壻����һ����Һ�м���0.5mol/L���ᱵ��Һ100mL��ǡ����ȫ��Ӧ�����������立��Ļ�ѧʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȱ��ʱ��ֲ�����ֳ�һ���IJ�֢�����иò�֢��ֲ��Ҷ������ʩ��������һ��Ũ�ȵĺ�����Һ�ò�֢��ʧ����˵������ֲ�����(����)
A. ����Ԫ�أ�����Ԫ��B. ����Ԫ�أ��DZ���Ԫ��
C. ��Ԫ�أ��DZ���Ԫ��D. ��Ԫ�أ�����Ԫ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com