
| 1 |
| 2 |
| 1 |
| 2 |
| A、0.01 | B、50 |
| C、100 | D、0.1 |
| 1 |
| 100 |
| 1 |
| 2 |
| 1 |
| 2 |
| 0.01 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应达平衡时N2的转化率为7.5% |
| B、反应进行到10s末时,H2的平均反应速率是0.0225mol?(L?s)-1 |
| C、该反应达到平衡时的标志是容器中气体压强不再改变 |
| D、该反应达到平衡时的标志是容器中气体密度不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、由CH2=CHCOOCH3合成的聚合物为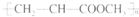 |
| B、溴乙烷与NaOH乙醇溶液共热生成乙烯 |
| C、装饰材料中的甲醛和芳香烃会造成居室污染 |
| D、磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室用NaCl固体配制0.40mol/L的NaCl溶液250mL.
实验室用NaCl固体配制0.40mol/L的NaCl溶液250mL.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用物质A表示该反应的平均反应速率为0.2mol?L-1?s-1 |
| B、平衡时物质A和B的转化率相等 |
| C、平衡时物质B的浓度为0.2mol/L |
| D、若将容积体积压缩为1L,B的平衡浓度变为原来的2倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com