
| A. | 植物油不能使溴的四氯化碳溶液褪色( ) | |
| B. | 甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型不同 | |
| C. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 | |
| D. | 苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 |
分析 A、植物油中含有不饱和的碳碳双键;
B、甲烷与氯气反应生成一氯甲烷和苯与硝酸反应生成硝基苯都属于取代反应;
C、乙醇与碳酸钠溶液互溶,乙酸与碳酸钠溶液反应生成气体,而乙酸乙酯不能溶于碳酸钠溶液;
D、苯不能使酸性高锰酸钾溶液褪色,但可以发生氧化反应.
解答 解:A、植物油中含有不饱和的碳碳双键,能与溴发生加成反应,使溴的四氯化碳溶液褪色,故A错误;
B、甲烷与氯气反应生成一氯甲烷,甲烷中氢原子被氯原子取代,苯与硝酸反应苯中的氢原子被硝基取代生成硝基苯,都属于取代反应,故B错误;
C、乙醇与碳酸钠溶液互溶,乙酸与碳酸钠溶液反应生成气体,而乙酸乙酯不能溶于碳酸钠溶液,与碳酸钠溶液分层,现象不同,能鉴别,故C正确;
D、苯不能使酸性高锰酸钾溶液褪色,但苯能燃烧,所以能发生氧化反应,故D错误;
故选C.
点评 本题考查有机物的反应类型、有机物的性质,难度不大,注意取代反应和加成反应的区别.


科目:高中化学 来源: 题型:解答题
 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图所示为电池示意图,该电池电极表面均匀地镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图所示为电池示意图,该电池电极表面均匀地镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A~F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示.
A~F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示.| 元素 | 原子结构或性质 |
| A | 原子最外层电子数是内层电子总数的$\frac{1}{5}$ |
| B | 形成化合物种类最多的元素,其单质为固体 |
| C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D | 地壳中含量最多的元素 |
| E | 与D同主族 |
| F | 与E同周期,且最外层电子数等于电子层数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.
元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R的最高价氧化物对应的水化物的酸性比X的弱 | |
| B. | 非金属性:Y>X | |
| C. | 原子半径的大小顺序:X>Z | |
| D. | Z元素最高价氧化物对应的水化物具有两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
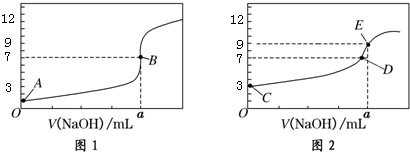
| A. | 图1是滴定CH3COOH 溶液的曲线 | |
| B. | 图2若用甲基橙作指示剂达到滴定终点时,则溶液由黄色变为红色 | |
| C. | 点D所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 如果C、E两点对应的pH分别为3、9,则水电离的氢离子浓度之比为1:100 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中不一定含有金属元素 | |
| B. | 由不同原子所形成的纯净物不一定是化合物 | |
| C. | 分子中一定含有化学键 | |
| D. | 含有金属元素的离子不一定是阳离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com