
【题目】下列说法正确的是
A.氯气有氧化性,可使干燥布条漂白褪色
B.常温下,铁、铝不与浓硫酸反应,因此可用铁、铝容器贮存运输浓硫酸
C.已知电离能力H2CO3>HClO>![]() ,则向氯水中加入碳酸氢钠晶体,能提高溶液中HClO的浓度
,则向氯水中加入碳酸氢钠晶体,能提高溶液中HClO的浓度
D.向BaCl2溶液中通入SO2可产生白色浑浊
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】下列实验“操作和现象”与“结论”对应关系正确的是![]()
操作和现象 | 结论 | |
A | 常温下,将Al箔插入浓 | 铝和浓硝酸不反应 |
B | 向饱和 | 析出了 |
C | 用铂丝蘸取溶液进行焰色反应,观察到火焰呈黄色 | 该溶液一定是钠盐溶液 |
D | 向装有 |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车发动机工作时会产生包括CO、NOx等多种污染气体,涉及到如下反应:
①N2(g)+O2(g)![]() 2NO(g)
2NO(g)
②2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
③NO2(g)+CO(g)![]() CO2(g)+NO(g)
CO2(g)+NO(g)
弄清上述反应的相关机理,对保护大气环境意义重大,回答下列问题:
科学家研究出了一种高效催化剂,可以将CO和NO2两者转化为无污染气体,反应方程式为:2NO2(g)+4CO(g)=4CO2(g)+N2(g) △H<0
某温度下,向10L密闭容器中分别充入0.1molNO2和0.2molCO,发生上述反应,随着反应的进行,容器内的压强变化如表所示:
时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
压强/kPa | 75 | 73.4 | 71.95 | 70.7 | 69.7 | 68.75 | 68.75 |
回答下列问题:
若将温度降低,再次平衡后,与原平衡相比体系压强(p总)如何变化?___(填“增大”、“减小”或“不变”),原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BMO(Bi2MoO6)是一种高效光催化剂,可用于光催化降解苯酚,原理如图所示。下列说法不正确的是

A. 该过程的总反应:C6H6O+7O2![]() 6CO2+3H2O
6CO2+3H2O
B. 该过程中BMO表现较强氧化性
C. 降解产物的分子中只含有极性共价键
D. ①和②中被降解的苯酚的物质的量之比为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两个体积相同带活塞的容器,分别盛装一定量的颜色相同的NO2(g)和Br2(g),迅速将两容器同时压缩到原来的一半(假设气体不液化),下列说法正确的是( )

A.a→a′过程中,颜色突然加深,然后逐渐变浅,最终颜色比原来的浅
B.a′,b′的颜色一样深
C.a′的压强比a的压强2倍要小,b′的压强为b的压强的2倍
D.a′中的c(NO2)一定比b′中的c(Br2)小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,它们占据三个周期。Y原子最外层电子数是电子层数的3倍。同由W、X、Z和SO42-组成一种离子化合物的水溶液中滴加稀氢氧化钠溶液,产生沉淀与加入的氢氧化钠溶液的体积关系如图所示。下列说法正确的是( )
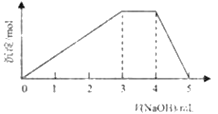
A.X、Y两种元素的非金属性强,其单质化学性质也很活泼
B.Z与X、Y形成的常见盐含有离子键和极性共价键
C.Z的最高价氧化物对应的水化物可溶于X的最简单氢化物的水溶液中
D.由W、X、Y三种元素只能组成一种盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3O4中含有![]() 、
、![]() ,分别表示为Fe(Ⅱ)、Fe(Ⅲ),以Fe3O4/Pd为催化材料,可实现用H2消除酸性废水中的致癌物NO2-,其反应过程示意图如图所示,下列说法不正确的是
,分别表示为Fe(Ⅱ)、Fe(Ⅲ),以Fe3O4/Pd为催化材料,可实现用H2消除酸性废水中的致癌物NO2-,其反应过程示意图如图所示,下列说法不正确的是

A. Pd上发生的电极反应为:H2 - 2e- 2H+
B. Fe(Ⅱ)与Fe(Ⅲ)的相互转化起到了传递电子的作用
C. 反应过程中NO2-被Fe(Ⅱ)还原为N2
D. 用该法处理后水体的pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组设计如图所示实验装置探究H2S的制法和性质。若装置A产生的是有臭鸡蛋气味的硫化氢气体,则下列说法错误的是( )

A.装置B中的现象可证明溴的非金属性比硫强
B.酸X可以是稀硝酸
C.装置C中的现象可证明CuS难溶于稀硫酸
D.能观察到装置D中溶液的红色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
I.将水蒸气通过红热的炭即可产生水煤气。反应为:
C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
能使化学反应速率加快的措施有________(填序号)。
①增加C的物质的量 ②升高反应温度
③随时吸收CO、H2转化为CH3OH ④密闭定容容器中充入CO(g)
II.工业上用CO生产燃料甲醇.一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g).
CH3OH(g).

(1)图1是表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况.从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=________________________;
(2)图2表示该反应进行过程中能量的变化.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化.写出该反应的热化学方程式___________;
(3)该反应平衡常数K为___________;
(4)恒容条件下,下列措施中能使![]() 增大的有__________;
增大的有__________;
a.升高温度 b.充入He气c.再充入2molH2 d.使用催化剂.
III. 下图是表示在一容积为2 L的密闭容器内加入2 mol的CO和6 mol的H2,在一定条件下发生如下反应:CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0,该反应的逆反应速率与时间的关系曲线:
CH3OH(g) ΔH<0,该反应的逆反应速率与时间的关系曲线:

①由图可知反应在t1、t3、t7时都达到了平衡,而在t2、t8时都改变了条件,试判断t8时改变的条件可能是_______________。
②若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com