
【题目】把VL含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含amolNaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另—份加入含bmolBaCl2的溶液;恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为 ( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
【答案】D
【解析】
试题分析:混合溶液分成两等份,每份溶液浓度与原溶液浓度相同,一份加BaCl2的溶液发生Ba2++SO42-═BaSO4↓,由方程式可知n(SO42-)=n(Ba2+)=n(BaCl2)=bmol;另一份加氢氧化钠溶液时发生Mg2++2OH-═Mg(OH)2↓,由方程式可知每份溶液中n(Mg2+)=1/2n(OH-)=a/2mol。由电荷守恒可知每份中2n(Mg2+)+n(K+)=2n(SO42-),故每份中溶液n(K+)=2b-2×a/2mol=(2b-a)mol。则原混合溶液中钾离子的浓度为[(2ba)mol]/(0.5V)=[2(2ba)]/Vmol/L,选项D正确。故选D。


科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系如图所示。

则甲和X不可能是
A. 甲为C,X为O2
B. 甲为SO2,X为NaOH溶液
C. 甲为Fe,X为Cl2
D. 甲为硝酸溶液,X为Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2(g)+3H2(g)![]() 2NH3(g) △H2=-92.4kJ/mol ,有关数据及特定平衡状态见下表。
2NH3(g) △H2=-92.4kJ/mol ,有关数据及特定平衡状态见下表。
容器 | 起始投入 | 达平衡时 | ||
甲 | 2molN2 | 3molH2 | 0molNH3 | 1.5molNH3 |
乙 | amolN2 | bmolH2 | 0molNH3 | 1.2molNH3 |
(1)若平衡后同种物质的体积分数相同,起始时乙容器通入的N2的物质的量为 ,起始时乙中的压强是甲容器的 倍,乙的平衡常数为
(2)恒容密闭容器中可以发生氨气的分解反应,达平衡后,仅改变下表中反应条件x,下列各项中y随x的增大而增大的是 (选填序号)。
a | b | c | d | |
x | 温度 | 温度 | 加入H2的物质的量 | 加入氨气的物质的量 |
y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时氨气的转化率 |
(3)研究在其他条件不变时,改变起始物氢气的物质的量对反应的影响,实验结果如图所示(图中T表示温度,n表示物质的量):
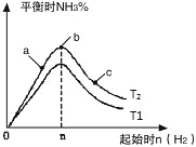
像中T2和T1的关系是:T2 T1(填“高于”“低于”“等于”“无法确定”)。
②a、b、c三点中,N2转化率最高的是 (填字母)。
③若容器容积为1L,T2℃在起始体系中加入1molN2,3molH2,经过5min反应达到平衡时H2的转化率为60%,则NH3的反应速率为 。保持容器体积不变,若起始时向容器内放入2molN2和6molH2,达平衡后放出的热量为Q,则Q_________110.88kJ(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以黄铜矿和硫磺为原料制取钢和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:

已知:“反应Ⅱ”的离子方程式为Cu2++CuS+4Cl-=2[CuCl2]-+S
回答下列问题:
(1)铁红的化学式为________;
(2)“反应Ⅱ”的还原剂是________(填化学式);
(3)除CuS外“反应II”的产物还有_________(填化学式);
(4)“反应Ⅲ”的离子方程式为_________;
(5)某同学设想利用电化学原理实现以CuSO4、SO2为原料制备Cu和H2SO4,并吸收炼铁过程中产生的CO尾气,实现资源与能源的综合利用。该同学据此组装出的装置如下图所示:

闭合该装置中的K,A池中通入SO2的Pt电极的电极反应式为__________,B池中生成的气体X的电子式为________,若在C池中生成64gCu,则整个装置中共生成H2SO4_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,请回答下列问题:

(1)A电极是_________(填“正极”或“负极”),在导线中电子的移动方向为_____(填“A→b”或“b-a”)。
(2)B电极的电极反应式为_______________,发生氧化反应的电极为______(填“A”或“B”)极。
(3)溶液中K+向_______(填“左”或“右”)移动。
(4)若放电一段时间后,消耗甲烷2.24 L(标准状况),理论上外电路转移电子的物质的量为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某饱和一元醛发生银镜反应可得21.6g银;将等量的该醛完全燃烧,生成3.6g水。此醛可能是( )
A. 甲醛 B. 乙醛 C. 丙醛 D. 丁醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组的同学拟利用碘化亚铁与碳酸氢钠的反应来制备高纯度的碘化钠晶体。回答下列问题:

(1)碘化亚铁溶液的制备:将碘和铁粉按物质的量之比在![]() 之间配料,加入三颈烧瓶中(如图),然后加入适量水,并向装置中持续通入N2,在40-60℃下搅拌反应30-50min,待反应完成检验出反应液中不含碘单质后,过滤即制得碘化亚铁溶液。
之间配料,加入三颈烧瓶中(如图),然后加入适量水,并向装置中持续通入N2,在40-60℃下搅拌反应30-50min,待反应完成检验出反应液中不含碘单质后,过滤即制得碘化亚铁溶液。
①配料中铁粉过量的目的是____________;持续通入N2的目的是___________。
②检验反应液中不含碘单质的方法是___________。
(2)碘化钠溶液的制备:将制备好的碘化亚铁溶液加入碳酸氢钠溶液中,控制碘化亚铁与碳酸氢钠的物质的量之比在![]() ,在80-100℃下,反应30-50 min,反应生成碘化钠及硫酸亚铁等。该反应的化学方程式为____________。
,在80-100℃下,反应30-50 min,反应生成碘化钠及硫酸亚铁等。该反应的化学方程式为____________。
(3)点化钠的提纯与结晶:
①除去碘化钠溶液中以HCO3-的方法是____________。
②从碘化钠溶液中获得碘化钠晶体(20℃时溶解度为179/100g水,100℃时溶解度为302/100g水)的操作方法是________________。
(4)碘化钠的提度的测定:
该小组同学称取制得的碘化钠晶体18.1g,溶于水后加入50mL2.5mol/LAgNO3溶液,过滤、洗涤、干燥,称得沉淀的质量为28.2g。则碘化钠晶体的纯度为_________。(杂质不参与反应,结果保留至小数点后两位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍元素性质与铝元素性质相似,下列说法正确的是( )
A. 氯化铍是离子化合物
B. 氢氧化铍的碱性比氢氧化钙的碱性强
C. Be与NaOH溶液反应的离子方程式Be+2OH-=BeO22-+H2↑
D. 单质铍能与冷水剧烈反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com