
 SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径.
SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径.分析 (1)①燃料电池中,通入氧化剂的电极是正极、通入还原剂的电极是负极,该反应中C元素化合价由+2价变为-2价、H元素化合价由0价变为+1价,所以CO是氧化剂;
②若A为SO2,B为O2,C为H2SO4,负极上二氧化硫失电子和水反应生成硫酸根离子和氢离子;
③若A为NH3,B为O2,C为HNO3,则正极发生还原反应;
④由离子放电顺序可知,电解含有0.02molCuSO4和0.02molNaCl的混合溶液200ml,阳极上氯离子和氢氧根离子放电生成氯气和氧气,2Cl--2e-=Cl2↑,阴极上铜离子得电子;
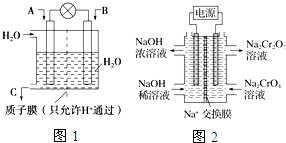
(2)根据2CrO42-+2H+?Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,需要通过电解电解消耗OH-提高溶液的酸性,说明在该电极是阳极,连接电源的正极,电极反应式为4OH--4e-═O2↑+2H2O.
解答 解:(1)①燃料电池中,通入氧化剂的电极是正极、通入还原剂的电极是负极,该反应中C元素化合价由+2价变为-2价、H元素化合价由0价变为+1价,所以CO是氧化剂,则通入CO的电极为正极,电极方程式为CO+4 e-+4H+=CH3OH,
故答案为:正;CO+4 e-+4H+=CH3OH;
②若A为SO2,B为O2,C为H2SO4,负极上二氧化硫失电子和水反应生成硫酸根离子和氢离子,电极反应式为SO2+2H2O-2e-=SO42-+4H+,
故答案为:SO2+2H2O-2e-=SO42-+4H+;
③若A为NH3,B为O2,C为HNO3,则正极发生还原反应,氧气得电子生成水,电极方程式为O2+4e-+4H+═2H2O,故答案为:O2+4e-+4H+═2H2O;
④计算得到,电解含有0.02mol CuSO4和0.02molNaCl的混合溶液200mL,当消耗标况下0.448L H2时,n(H2)=$\frac{0.448L}{22.4L/mol}$=0.02mol,
则电路中转移了0.04mol e-,依据电极反应和电子守恒分析判断:
阳极:2Cl--2e -=Cl2↑,
0.02mol 0.02mol 0.01mol
4OH--4e-=2H2O+O2↑,
0.02mol 0.02mol 0.005mol
阴极:Cu2++2e-=Cu
0.02mol 0.02mol
阳极氢氧根离子减少0.02mol,则溶液中氢离子增加0.02mol,溶液中氢离子浓度=$\frac{0.02mol}{0.2L}$=0.1mol/L,溶液PH=1,
故答案为:Cl2、O2,0.01mol、0.005mol;1;
(2)根据2CrO42-+2H+?Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,需要通过电解消耗OH-,提高溶液的酸性,说明在该电极是阳极,连接电源的正极,电极反应式为4OH--4e-═O2↑+2H2O,故答案为:正;4OH--4e-═O2↑+2H2O.
点评 本题考查原电池设计、燃料电池等知识点,会根据电池反应式确定正负极及电解质,发生氧化反应的金属作负极、不如负极材料活泼的金属或导电的非金属作正极,发生还原反应的电解质为原电池中电解质,会正确书写电极反应式,为高考高频点.


科目:高中化学 来源: 题型:选择题
| 选项化合物 | A | B | C | D |
| Y | CuO | H2O | SiO2 | FeCl3 |
| W | H2O | Fe3O4 | CO | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| B. | 电池中的重金属等污染土壤,可以回收再利用以减少污染、保护资源 | |
| C. | 人们日常生活中用到各种化学品,应尽量减少甚至不使用 | |
| D. | 城市机动车成为PM2.5(直径≤2.5微米的颗粒物,也称为可入肺颗粒物,有毒、有害)主要源头,必须加以控制 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
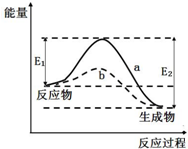
| A. | 该反应△H>0 | B. | a与b相比,a的反应速率更快 | ||
| C. | a与b相比,反应的平衡常数Ka=Kb | D. | 反应物总键能大于生成物总键能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过渡元素全部是金属元素 | |
| B. | 同周期第ⅡA族与第ⅢA族元素的原子序数差值一定是1 | |
| C. | 催化剂一般在金属与非金属的分界线处寻找 | |
| D. | 同一主族元素的原子序数的差不可能为10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
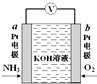 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )| A. | 溶液中OH-向电极a移动 | |
| B. | 负极的电极反应式为:2NH3-6e-+6OH-═N2↑+6H2O | |
| C. | O2在电极b上发生还原反应 | |
| D. | 反应消耗的NH3与O2的物质的量之比为4:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 向氯水中加入硝酸银溶液,有白色沉淀产生 | 氯水中已无Cl2 |
| B | 将SO2通入酸性高锰酸钾溶液,溶液紫色褪去 | SO2具有漂白性 |
| C | 向FeCl3和CuCl2混合溶液中加入少量铁粉,没有红色固体析出 | 氧化性:Fe3+>Cu2+ |
| D | 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 | 该溶液中含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
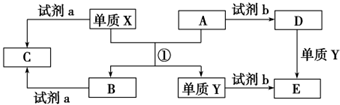
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com