
过氧化钠(Na2O2)是中学常见物质,常见的过氧化物还包括过氧化钙(CaO2)。已知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成。有人提出CO2、SO2与过氧化钠的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断。
实验一:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。
(1)提出假设:
假设1:反应后固体中只有Na2SO3,证明SO2未被氧化;
假设2:反应后固体中只有Na2SO4,证明SO2完全被氧化;
假设3:__________________________证明______________________。
实验探究:
实验二:通过测量气体的体积判断发生的化学反应,实验装置如下:
(2)试剂A可以选用________,试剂B的作用是________。
(3)实验测得装置C中过氧化钠质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下),用上述有关测量数据判断,SO2未被氧化、完全被氧化的V-m1关系式。
未被氧化:____________,完全被氧化:____________。
(4)若SO2完全被氧化,写出反应的化学方程式: __________________________。
(12分)(1)Na2SO3和Na2SO4的混合物(1分) SO2被部分氧化(1分)
(2)浓H2SO4 (2分) 吸收未反应的SO2(2分) (3)V=7m1/30 (2分) V=0 (2分)
(4)SO2+Na2O2=Na2SO4(2分)
解析试题分析:实验一:
(1)向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究:
假设1:反应后固体只有 Na2SO3,证明SO2未被氧化;
假设2:反应后固体中只有 Na2SO4,证明SO2完全被氧化;
假设3:固体为Na2SO3和Na2SO4的混合物;证明SO2部分被氧化;
实验二:
(2)过氧化钠和水反应,装置A中试剂能吸收水蒸气,所以试剂为浓硫酸,干燥气体除去水蒸气;装置B为测定生成氧气的体积,需要把剩余的二氧化硫除去,因此试剂B装置作用是吸收未反应的SO2。
(3)实验测得装置C中过氧化钠质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下)。若SO2未被氧化、则发生反应:2Na2O2+2SO2=2Na2SO3+O2。依据化学方程式和反应增重计算E中收集的氧气,即
2Na2O2+2SO2=2Na2SO3+O2 反应增重
1mol 96g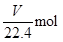 m1g
m1g
解得V=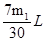
若二氧化硫全部被氧化发生的反应为:Na2O2+SO2=Na2SO4;反应过程中无氧气生成,V=0,
若0<V<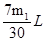 ,则二氧化硫部分被氧化。
,则二氧化硫部分被氧化。
(4)二氧化硫完全被氧化生成硫酸钠,反应的化学方程式为:SO2+Na2O2═Na2SO4。
考点:考查二氧化硫性质以及SO2和过氧化钠反应的实验探究
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力,提高学生的学科素养。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。实验设计的步骤和实验方案的确定应根据题干要求分析判断,关键是读懂题干信息,依据题干条件计算判断。


科目:高中化学 来源: 题型:实验题
现拟用图所示装置(尾气处理部分略)来制取一氧化碳,并用以测定某铜粉样品(混有CuO粉末)中金属铜的含量
(1)制备一氧化碳的化学方程式是 ;
(2)试验中,观察到反应管中发生的现象是 ;尾气的主要成分是 ;
(3)反应完成后,正确的操作顺序为 (填字母)
a.关闭漏斗开关 b.熄灭酒精1 c.熄灭酒精灯2
(4)若试验中称取铜粉样品5.0g,充分反应后,反应管中剩余固体的质量为4.8g,则原样品中单质铜的质量分数为 ;
(5)从浓硫酸、浓硝酸、蒸馏水、双氧水中选用合适的试剂,设计一个测定样品中金属铜质量分数的方案;
①设计方案的主要步骤是(不必描述操作过程的细节) ;
②写出有关反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
电石的主要成分为CaC2,易与水反应生成C2H2,故C2H2俗称电石气。某同学设计如下方案测定电石中CaC2的纯度(杂质不参加反应)。
实验原理:CaC2 +2H2O==Ca(OH)2+C2H2 ↑
通过测定生成的气体的体积(标准状况),可确定样品中CaC2的含量。
实验步骤:
①称取样品1.2g;
②把1.2g样品放入气密性良好的气体发生装置,如图所示;
③向样品中滴入水,至不再产生气泡,用量筒排水集气,量筒内液面在360mL处恰与水槽内液面相平;
④作为反应器的烧瓶中有24mL液体。
请回答下列问题:
(1)上述实验所用的玻璃仪器有导管、水槽、 、 、 。
(2)若实验前有1000mL、500 mL、250 mL的量筒备用,则应选用 mL的量筒。
(3)生成气体体积是 mL,为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是 。
(4)若将C2H2通入KMnO4溶液中,KMnO4溶液的紫红色会变浅,反应的化学方程式为□KMnO4+□C2H2+□H2SO4——□K2SO4+□MnSO4+□CO2+□ 。若该实验生成的C2H2完全被KMnO4溶液氧化,至少需0.1 mol·L-1的KMnO4溶液 mL。
(5)通过以上数据计算,可得样品中CaC2的纯度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学小组为了证明SO2和Cl2的漂白性,设计了如下图所示的实验装置:
A B C D E
(1)实验室制备Cl2依据的原理是(化学方程式): ,应选用上图A、E装置中的 (填序号)制Cl2,反应中浓盐酸所表现出的性质是 、 。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是 。
(3)NaOH溶液与Cl2反应的离子方程式: 。
(4)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
用纯碱和双氧水混合可制作新型液体洗涤剂(2Na2CO3?3H2O2),它具有杀菌消毒去油污的能力且不会污染水源。
(1)检验这种新型洗涤剂中金属阳离子的操作和现象是______________________;
(2)这种洗涤剂中的双氧水可以将废水中的氰化物转化为无毒物同时生成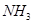 ,写出反应的离子方程式____________________________;
,写出反应的离子方程式____________________________;
(3)如果配制洗涤剂的水中含有铁离子,不仅会削弱洗涤剂的去污能力,甚至完全失去杀菌作用。试分析其中的原因(写出其中一种即可,用离子方程式和简要文字表述):
__________________________________________________;
(4)某化学学习小组为了定性探究铁离子对这种新型洗涤剂的不良影响,取该洗涤剂100mL,加入25g FeCl3固体,产生大量无色无味气体,用贮气瓶收集气体。请选用下列试剂和实验用品完成气体成分的探究过程:0.10 mol?Lˉ1NaOH溶液、8.0 mol?Lˉ1NaOH溶液、澄清石灰水、0.01 mol?Lˉ1KMnO4溶液、BaCl2稀溶液、品红溶液、蒸馏水、木条、酒精灯、火柴、洗气瓶。
①提出假设:对该气体成分提出合理假设。
假设1:气体是O2; 假设2:气体是_____; 假设3:气体是CO2。
②设计方案:设计实验方案证明你的假设,在下表中完成实验步骤、预期现象与结论:
| 实验步骤 | 预期现象与结论 |
| 将气体依次通入盛有_______、________的洗气瓶中,________________________。 | |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
( 14分)某化学小组进行Na2O2与水反应的实验,如下图所示,该小组对试管c中红色褪去的原因进行探究。
(1)Na2O2中含有的化学键类型: ;请写出a中反应的化学方程式 。
查阅资料:
①当NaOH溶液pH≥13时,可以使酚酞由红色褪为无色;
②Na2O2与水反应分两步进行:Na2O2 + H2O =" NaOH" + H2O2 2H2O2 = 2H2O + O2↑
(2)请设计实验验证Na2O2与水反应后的溶液中有H2O2残留:取少量b溶液于试管中, ,证明溶液中有H2O2残留。
(3)结合资料,该小组同学针c中溶液红色褪去的原因提出以下假设:
① ;
② 溶液中H2O2破坏酚酞的结构;
③ NaOH和H2O2共同作用结果。
(4)该小组同学测出c中溶液的pH为14,认为还不能排除假设②、③,于是又进行了如下实验,请完成下表空白处:
| 实验 | 操作 | 现象 | 结论 |
| 1 | 向少量H2O2中滴加2滴酚酞,放置一段时间,再加入NaOH溶液至pH=12 | 加入NaOH后,无色溶液先变红,后褪色 | ① |
| 2 | 向少量 NaOH溶液(pH=14)中滴加2滴酚酞;再加适量稀盐酸至溶液 pH=12 | 溶液先变红,后褪色;加盐酸后,又出现红色,且不褪色 |  |
| 3 | 向Na2O2与水反应后的溶液(pH=14)中滴加2滴酚酞;再加适量稀盐酸至溶液 pH=12 …… | ② …… | 溶液pH大于13时,NaOH使变红的溶液褪色;pH在8~13时, NaOH和H2O2共同作用使溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(12分)正丁醛是一种化工原料。某实验小组利用如右装置合成正丁醛。发生的反应如下: 。反应物和产物的相关数据列表如下:
。反应物和产物的相关数据列表如下:
| | 沸点/℃ | 密度/g·cm-3 | 水中溶解性 |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
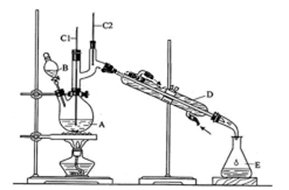
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
下图中的实验装置可以用于实验室制取乙炔。请填空:
(1) 图中A管的作用是 ,
制取乙炔的化学反应方程式为 。
(2)乙炔通入酸性KMnO4溶液中,发生 反应,可以观察到
现象,若通入溴水中,发生 反应。
(3)乙炔燃烧的化学方程式为 ,燃烧时的现象为 ,
为了安全,点燃乙炔前应该先 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对下列与化学有关的社会和生活问题作出判断,其中不正确的是
| A.白酒标签上注有“酒精浓度53%VOl”字样,它表示100g该白酒中含有53g酒精 |
| B.蒸馒头时,在发酵的面团里加入一些纯碱可使馒头发泡 |
| C.“地沟油”可用于生产肥皂或用作燃料,以变废为宝 |
| D.婴儿“尿不湿”中的聚丙烯钠具有很强的吸水性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com