
| A. | 1mol Cl2参加反应转移电子数一定为2NA | |
| B. | 1mol NaHCO3晶体中阳离子数为2NA | |
| C. | 常温常压条件下,14g乙烯和丁烯混合物含有的共用电子对数为3NA | |
| D. | 1ml•L-1 NaCl溶液中含有的Na+数为NA |
分析 A.氯气参与反应时可能只做氧化剂被还原,也可能既做氧化剂又做还原剂,发生歧化反应;
B.硫酸氢钠中含有阳离子为钠离子;
C.乙烯和丁烯符合通式CnH2n,求出CnH2n的物质的量,然后根据1molCnH2n含3nmol共用电子对来计算;
D.溶液的体积不清楚,无法求微粒的数目.
解答 解:A.氯气参与反应时可能只做氧化剂被还原,此时1mol氯气转移2mol电子;但氯气也可能既做氧化剂又做还原剂,发生歧化反应,如在与NaOH溶液的反应中:Cl2+2NaOH=NaCl+NaClO+H2O,1mol氯气参与反应时转移1mol电子,故A错误;
B.在1mol NaHCO3晶体中,含有1mol钠离子,故含有阳离子数为NA,故B错误;
C.乙烯和丁烯符合通式CnH2n,故14gCnH2n的物质的量n=$\frac{14g}{14ng/mol}$=$\frac{1}{n}$mol,而1molCnH2n含3nmol共用电子对,故$\frac{1}{n}$molCnH2n含3mol共用电子对,即共用电子对数为3NA,故C正确;
D.溶液的体积不清楚,无法求微粒的数目,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握公式的运用和物质的结构是关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
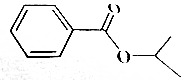 某有机物结构如图所示,有关该物质的叙述正确的是( )
某有机物结构如图所示,有关该物质的叙述正确的是( )| A. | 该物质易溶于水,不溶于乙醇、乙醚 | |
| B. | 该物质能发生加成、氧化.水解等反应 | |
| C. | 1mol该物质最多能与4mol氢气加成 | |
| D. | 该物质所有碳原子可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
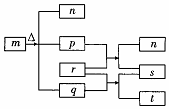 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,常温常压下,p为无色无味气体,q为液态,r为淡黄色固体,s是气体单质.上述物质的转化关系如图所示.下列说法错误的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,常温常压下,p为无色无味气体,q为液态,r为淡黄色固体,s是气体单质.上述物质的转化关系如图所示.下列说法错误的是( )| A. | 原子半径:Z>Y>X | B. | 最简单气态氢化物的稳定性:Y>X | ||
| C. | m、n、r都含有离子键和共价键 | D. | m、n、t都能破坏水的电离平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 催化液化I中使用催化剂,反应的活化能Ea、△H2都减小 | |
| B. | 反应C(s)+H2O(g)+H2(g)=CH3OH(g)△H=41.1 kJ•mol-1 | |
| C. | △H2>△H3 | |
| D. | 图为甲醇燃料电池的工作原理,负极的电极反应为:CH3OH-6e-+6OH-═CO2+5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 除杂试剂 | 实验方法 |
| A | 除去CuCO3固体中的(NH4)2CO3 | - | 置于坩埚中加热至恒重 |
| B | 除去Ag2S中少量AgCl | Na2S溶液 | 过滤 |
| C | 除去乙稀中的SO2气体 | 酸性高锰酸钾溶液 | 洗气 |
| D | 除去甘油中的乙酸 | NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 | |
| X | 中和反应 | 无现象 | 溶解 | 产生氢气 |
| Y | 无现象 | 有银镜 | 加热后有砖红色沉淀 | 产生氢气 |
| Z | 水解反应 | 有银镜 | 加热后有砖红色沉淀 | 无现象 |
| W | 水解反应 | 无现象 | 无现象 | 无现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com