
下列各组离子一定能大量共存的是( )
|
| A. | 在含大量Fe3+的溶液中:NH4+、Na+、Cl﹣、SCN﹣ |
|
| B. | 在强碱溶液中:Na+、K+、AlO2﹣、CO32﹣ |
|
| C. | 在c(H+)=10﹣13mol/L的溶液中:NH4+、Al3+、SO42﹣、NO3﹣ |
|
| D. | 在pH=0的溶液中:K+、Fe2+、Cl﹣、NO3﹣ |
考点:
离子共存问题.
专题:
离子反应专题.
分析:
A.Fe3+与SCN﹣发生络合反应;
B.强碱溶液中存在大量的OH﹣;
C.c(H+)=10﹣13mol/L的溶液呈碱性,存在大量的OH﹣;
D.pH=0的溶液呈酸性,存在大量的H+.
解答:
解:A.Fe3+与SCN﹣发生络合反应生成Fe(SNC)3而不能共存,故A错误;
B.强碱溶液中存在大量的OH﹣,离子之间不发生任何反应,可以大量共存,故B正确;
C.c(H+)=10﹣13mol/L的溶液呈碱性,存在大量的OH﹣,NH4+与OH﹣反应生成NH3•H2O,A13+与OH﹣反应生成沉淀而不能大量共存,故C错误;
D.pH=0的溶液呈酸性,存在大量的H+,Fe2+与NO3﹣发生氧化还原反应而不能大量共存,故D错误.
故选B.
点评:
本题考查离子共存问题,题目难度中等,注意常见离子的性质,判断离子之间能否发生反应,注意题目的要求.


科目:高中化学 来源: 题型:
稀氨水中存在下述电离平衡:NH3+H2O⇌NH3•H2O⇌NH4++OH﹣加入下列物质:请在答题卡上相应空格处填上:正向移动、逆向移动或不移动.
| 加入的物质 | NH4Cl | NH3 | NaOH |
| 平衡移动的方向 | (1) | (2) | (3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
一真空定容的密闭容器中盛有1mol PCl5,发生反应PCl5(g)⇌PCl3(g)+Cl2(g),一定条件下平衡时PCl5所占的体积百分数为M,若相同条件相同容器中,最初放入2mol PCl5,则平衡时,PCl5的体积百分数为N,下列结论正确的是( )
|
| A. | M>N | B. | M=N | C. | M<N | D. | 无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在100℃时,PH=7呈 性.
(2)碳酸钠溶液呈碱性的原因,用离子方程式表示: .
(3)氯化铝溶液呈酸性的原因,用离子方程式表示:
(4)写电离方程式NaHCO3
(5)由氢气和氧气反应生成1mol水蒸气放热241.8KJ,写出该反应的热化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D四块金属片,进行如下实验:
①A、B用导线相连后,同时浸入稀硫酸溶液中,A极为负极;
②C、D用导线相连后,同时浸入稀硫酸溶液中,电流由D→导线→C;
③A、C相连后,同时浸入稀硫酸溶液中,C极产生大量气泡;
④B、D相连后,同时浸入稀硫酸溶液中,D极发生氧化反应.
据此,判断四种金属的活动性顺序是( )
|
| A. | A>B>C>D | B. | A>C>D>B | C. | C>A>B>D | D. | B>D>C>A |
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂。试回答下列问题:
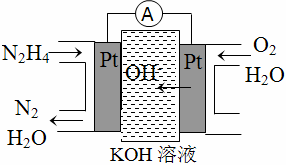
(1)肼燃料电池原理如图所示,左边电极上发生的电极反应式为____________________________________。
(2)火箭常用N2O4作氧化剂,肼作燃料,已知:
N2(g)+2O2(g) 2NO2(g) ΔH=-67.7kJ·mol-1
2NO2(g) ΔH=-67.7kJ·mol-1
N2H4(g)+O2(g) N2(g)+2H2O(g) ΔH=-534.0kJ·mol-1
N2(g)+2H2O(g) ΔH=-534.0kJ·mol-1
2NO2(g) N2O4(g) ΔH=-52.7kJ·mol-1
N2O4(g) ΔH=-52.7kJ·mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:________________________________________________________________。
(3)联氨的工业生产常用氨和次氯酸钠为原料获得,也可在高锰酸钾催化下,尿素[CO(NH2)2]和次氯酸钠—氢氧化钠溶液反应获得,尿素法反应的离子方程式为_____________________________________________________。
(4)如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊。关闭K2,将各1 mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L。
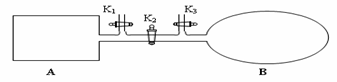
①B中可通过__________________________判断可逆反应2NO2 N2O4已经达到平衡。
N2O4已经达到平衡。
②若平衡后在A容器中再充入0.5mol N2O4,则重新到达平衡后,平衡混合气中NO2的体积分数________(填 “变大”、“变小”或“不变”)
③若容器A中到达平衡所需时间t s,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率v(NO2)等于____________________。
④若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为______L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com