
【题目】下列关于热化学反应的描述中正确的是( )
A.已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则:2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l) ΔH=-114.6kJ·mol-1
B.将甲醇蒸气转化为氢气的热化学方程式是:CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1,则CH3OH(g)的燃烧热为192.9kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1,则CH3OH(g)的燃烧热为192.9kJ·mol-1
C.已知氢在氯气中燃烧的热化学方程式为H2(g)+Cl2(g)=2HCl(g) ΔH=-285.8kJ/mol,所以H2(g)的燃烧热是285.8kJ·mol-1,
D.葡萄糖的燃烧热是2 800 kJ·mol-1,则![]() C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ·mol-1
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ·mol-1
【答案】D
【解析】
A. 硫酸和氢氧化钡反应除酸碱中和放热,生成硫酸钡沉淀过程也会放热,2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l) △H<114.6kJmol1,故A错误;
B. 燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,选项中生成的氢气不是稳定氧化物,反应放出的热量不是甲醇的燃烧热,故B错误;
C. 燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,氢气和氯气的反应不符合燃烧热的定义,故C错误;。
D. 葡萄糖的燃烧热是1mol葡萄糖燃烧生成稳定氧化物二氧化碳和液体水放出的热量,葡萄糖的燃烧热是2800kJmol1,则热化学方程式为: ![]() C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=1400kJmol1,故D正确;
C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=1400kJmol1,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】在室温下,下列五种溶液:
①0.1 mol/L NH4Cl ②0.1 mol/L CH3COONH4 ③0.1 mol/L NH4HSO4 ④0.1 mol/L NH3·H2O和0.1 mol/L NH4Cl混合液 ⑤0.1 mol/L NH3·H2O,请根据要求填写下列空白:
(1)溶液①呈______性(填“酸”“碱”或“中”),其原因是_____________(用离子方程式表示)
(2)在溶液④中______离子的浓度为0.1mol/L;NH3·H2O和_____离子的量浓度之和为0.2mol/L。
(3)室温下,测得溶液②的pH=7,则说明CH3COO-的水解程度_______(填“>”“<”或“=”)NH4+的水解程度,CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)______c(NH4+)
(4)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。
①写出酸H2A的电离方程式________。
②若溶液M由10mL 2mol·L-1NaHA溶液与2mol·L-1NaOH溶液等体积混合而得,则溶液M的pH________7(填“>”、“<”或“=”)。
(5)已知:在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液。回答下列问题:
①两溶液中,c(H+)·c(OH-)=__________。
②各取5mL上述溶液,分别加水稀释至50mL,pH较大的是________溶液。
③各取5mL上述溶液,分别加热到90℃,pH较小的是__________溶液。
④H2SO4和NH4Cl两溶液中,由水电离出的c(H+)分别为__________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第ⅤA族元素的原子R与A原子结合形成![]() 气态分子,其立体结构呈三角锥形.
气态分子,其立体结构呈三角锥形.![]() 在气态和液态时,分子结构如图所示,下列关于
在气态和液态时,分子结构如图所示,下列关于![]() 分子的说法中不正确的是
分子的说法中不正确的是![]()
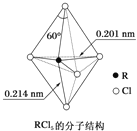
A.分子中5个![]() 键键能不都相同
键键能不都相同
B.键角![]() 有
有![]() 、
、![]() 、
、![]() 几种
几种
C.![]() 受热后会分解生成分子立体结构呈三角锥形的
受热后会分解生成分子立体结构呈三角锥形的![]()
D.每个原子都达到8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定法是一种重要的定量分析方法,应用范围很广。
(1)下图是用0.100 0 mol·L-1的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后盛放盐酸的滴定管中液面的位置。
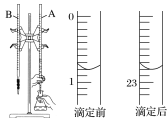
请回答下列问题:
①仪器A的名称是____________。
②盐酸的体积读数:滴定后读数为________mL。
(2)玉溪市场上销售的“白象牌”食用精制盐包装袋上有如下部分说明:
产品等级 | 一级 |
配料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50 mg·kg-1 |
某学生拟测定食用精制盐的碘(KIO3)含量,其步骤:
a.准确称取W g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.加入指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全(I2+2S2O32-===2I-+S4O62-)。
①c中指示剂是_______________,判断c中恰好完全反应所依据的现象是___________。
②写出步骤b的离子方程式_____________________。
③b中反应所产生的I2的物质的量是________ mol。
④根据以上实验和包装袋说明,算得所测食用精制盐的碘含量是(以含W的代数式表示)_______mg·kg-1。
⑤若滴定前滴定管尖嘴处有气泡,滴定后消失,则测定结果________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:
Cu(NH3)2Ac+CO+NH3![]() [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是_________。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式_______________
(3)简述铜液吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)。
__________________________________________
(4)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为_______________。其中氮元素原子最外层电子排布的轨道表达式是_________________________。通过比较_____________可判断氮、磷两种非金属元素的非金属性强弱。
(5)已知CS2与CO2分子结构相似,CS2的电子式是____________。CS2熔点高于CO2,其原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有浓度均为0.1mol·L-1的下列溶液:①盐酸 ②醋酸 ③氢氧化钠 ④氯化铵 ⑤硫酸氢铵 ⑥氨水,请回答下列问题:
(1)已知t ℃时,Kw=1×10-13,则t ℃(填“>” “<”或“=”)__25℃。
(2)②③④三种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)____。
(3)已知④溶液呈酸性,请用离子方程式表示___。
(4)④⑤⑥四种溶液中NH4+浓度由大到小的顺序是(填序号)____。
(5)常温下,将①和③按体积比2:1混合后,溶液的pH约为____(已知lg3=0.5)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )

A.电负性:![]()
B.离子半径:![]()
C.Z元素基态原子最外层电子排布图为![]()
D.![]() 分子中各原子的最外层均满足8电子稳定结构
分子中各原子的最外层均满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g)![]() 2CO2(g) ΔH=566.0kJ/mol
2CO2(g) ΔH=566.0kJ/mol
②N2(g)+O2(g)![]() 2NO(g) ΔH=+180.5kJ/mol
2NO(g) ΔH=+180.5kJ/mol
③2NO(g)+O2(g)![]() 2NO2(g) ΔH=116.5kJ/mol
2NO2(g) ΔH=116.5kJ/mol
回答下列问题:
(1)CO的燃烧热为___。若1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收946kJ、498kJ的能量,则1molNO(g)分子中化学键断裂时需吸收的能量为___kJ。
(2)CO将NO2还原为单质的热化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述中正确的是
A. 任何能使熵值增大的过程都能自发进行
B. △H<0,△S>0的化学反应一定能自发进行
C. 已知热化学方程式2SO2(g)+O2(g)![]() 2SO3(g)△H=-QkJ·mol-1(Q>0),则将2mol SO2(g) 和1mol O2(g) 置于一密闭容器中充分反应后放出Q kJ的热量
2SO3(g)△H=-QkJ·mol-1(Q>0),则将2mol SO2(g) 和1mol O2(g) 置于一密闭容器中充分反应后放出Q kJ的热量
D. 稀溶液中1mol NaOH分别和1mol CH3COOH、1molHNO3反应,两者放出的热量一样多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com