
【题目】以磷石膏(主要成分是CaSO4,含少量的Al2O3、SiO2等杂质)为原料制备Na2SO4、CaBr2·2H2O和NH4Cl等产品的工艺流程如下:
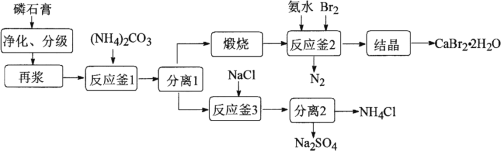
请回答:
(1) 反应釜1中![]() 的浸出率与加料速度、反应温度的关系如下图所示:
的浸出率与加料速度、反应温度的关系如下图所示:
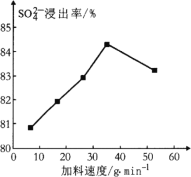

①反应的最佳条件为________。
②其它条件相同时,![]() 浸出率随反应温度先升后降的原因是________。
浸出率随反应温度先升后降的原因是________。
(2) 实验室里模拟上述煅烧操作,下列仪器中有用到的是________。
A 瓷坩埚 B 铁坩埚
C 酒精灯 D 酒精喷灯
(3) 反应釜2中进行的反应是________。
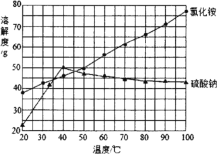
(4) 反应釜3中完成反应后,分离硫酸钠、氯化铵的操作:在90℃左右蒸发浓缩至较多晶体析出→________得到Na2SO4粗品;同时,将热滤液________→得NH4Cl粗品(Na2SO4、NH4Cl的溶解度如图所示)。
【答案】加料速度为36 g·min1、反应温度为40℃ (温度低于40℃反应速率慢)温度在30~40℃时,温度越高反应速率越快;高于40℃(NH4)2CO3受热分解 BD 3CaO+2NH3·H2O+3Br2=3CaBr2+N2+5H2O或3CaO+2NH3+3Br2=3CaBr2+N2+3H2O 趁热过滤 冷却至35℃左右、趁热过滤或冷却至35~40℃过滤
【解析】
(1)根据图象找出硫酸根离子浸出率最高的加料速度和温度;
(2)根据温度对反应速率的影响和温度对碳酸铵的影响分析;
(3)根据煅烧碳酸钙时不能与容器反应分析使用的容器,根据煅烧的温度选择加热仪器。
(4)根据已给反应物分析反应产物,根据元素化合价变化分析。
(5)物质的溶解度变化曲线分析分离提纯的方法。
(1) ①从图分析,加料速度为36 g·min1、反应温度为40℃时硫酸根离子浸出率最高,为最佳条件;
②反应釜1中加入碳酸铵,随着温度升高,(温度低于40℃反应速率慢)温度在30~40℃时,反应速率越快硫酸根离子浸出率升高;高于40℃(NH4)2CO3受热分解,硫酸根离子的浸出率降低;
(2)因为是煅烧碳酸钙,其与瓷坩埚中的二氧化硅反应,所以选择铁坩埚,煅烧需要较高的温度,选择酒精喷灯,故选BD;
(3).碳酸钙煅烧后生成氧化钙和二氧化碳,加入氨水和溴反应生成溴化钙,因为溴元素化合价降低,所以有氮元素化合价升高生成氮气,方程式为: 3CaO+2NH3·H2O+3Br2=3CaBr2+N2+5H2O或3CaO+2NH3+3Br2=3CaBr2+N2+3H2O;
(4)根据氯化铵和硫酸钠的溶解度曲线分析,随着温度升高,硫酸钠的溶解度降低,而氯化铵的溶解度升高,所以在在90℃左右蒸发浓缩至较多晶体析出趁热过滤得到硫酸钠晶体,滤液冷却至35℃左右、趁热过滤或冷却至35~40℃过滤可得到氯化铵晶体。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】我国某科研团队设计了一种新型能量存储/转化装置(如下图所示)。闭合K2、断开K1时,制氢并储能;断开K2、闭合K1时,供电。下列说法错误的是
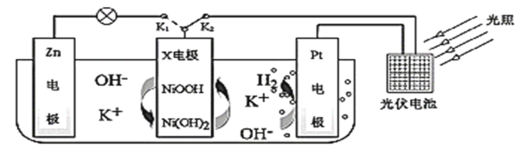
A.制氢时,溶液中K+向Pt电极移动
B.制氢时,X电极反应式为![]()
C.供电时,Zn电极附近溶液的pH升高
D.供电时,装置中的总反应为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业中很多重要的化工原料都来源于石油化工,如图中的苯、丙烯、有机物A等,其中A的年产量可以用来衡量一个国家的石油化工发展水平。请回答下列问题:

(1)A的结构简式为_______,丙烯酸中含氧官能团的名称为______;
(2)写出下列反应的反应类型①________,④________;
(3)下列说法正确的是:________;
A.为除去硝基苯中混有的浓HNO3和H2SO4,可将其倒入到NaOH溶液中,静置,分液
B.除去乙酸乙酯中的乙酸,加NaOH溶液、分液
C.有机物C与丙烯酸属于同系物
(4)写出④的反应方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某常见微粒X的结构模型可表示为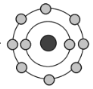 (
(![]() 代表电子),下列有关X的说法正确的是( )
代表电子),下列有关X的说法正确的是( )
A.微粒X的组成元素不可能是第三周期元素
B.X的组成元素一定是氖元素
C.若X的组成元素原子的核电荷数为8,则X是![]()
D.若X的核内质子数比电子数多,则X最多有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化:
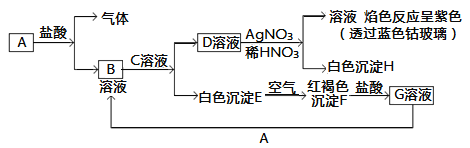
试回答:
(1)写出B的化学式________,D的化学式________。
(2)写出由E转变成F的化学方程式________________________。
(3)写出用KSCN鉴别G溶液的离子方程式________________;向G溶液加入A的有关离子反应方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和硫的氧化物的综合利用是目前研究的热点之一。已知:
i.N2(g)+O2(g)=2NO(g) △H=+180.0 kJ·mol-1
ii.2SO2(g)+O2(g)=2SO3(g) △H=-196.6 kJ·mol-1
iii.2NO(g)+O2(g)=2NO2(g) △H=-113.0 kJ·mol-1
(1)反应iV:2NO2(g)+2SO2(g)=2SO3(g)+N2(g)+O2(g)的 △H=________;该反应在密闭容器中达到平衡后,只改变下列条件,一定能使N2的平衡体积分数增大的是______(填选项字母)。
A 缩小容器容积 B 再充入SO2 C 降低温度 D 分离出SO3
(2)T1°C时,容积相等的密闭容器中分别充入NO2和SO2的混合气体4 mol,发生反应iV。NO2或SO2的平衡转化率(a)与起始充入的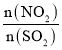 关系如图1所示。
关系如图1所示。
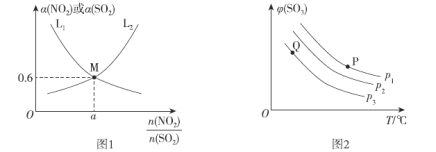
①图中能表示平衡时a(SO2)与起始充入的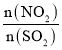 关系的曲线为_____(填“L1”或“L2”)。
关系的曲线为_____(填“L1”或“L2”)。
②反应的平衡常数K=________。
(3)向密闭容器中充入一定量SO2和O2,发生反应ii。SO3的平衡体积分数(φ)与温度(T)和压强(p)的关系如图2所示。
①P1、P2 、P3由大到小的顺序为__________。
②P、Q两点对应状态下,单位体积内反应物活化分子数目:P__________Q(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.NaHSO3溶液中的水解方程式:HSO3+H2O=H3O++![]()
B.FeI2溶液中加双氧水,出现红褐色沉淀:6Fe2++3H2O2=2Fe(OH)3↓+4Fe3+
C.10 mL 0.1 mol·L1 NaOH溶液中滴加几滴AlCl3溶液:Al3++3OH=Al(OH)3↓
D.3a mol CO2通入含2a mol Ba(OH)2的溶液中:3CO2+4OH+Ba2+=BaCO3↓+2![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.甘油醛(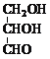 )和葡萄糖均属于单糖,互为同系物
)和葡萄糖均属于单糖,互为同系物
B.2,3,5,5四甲基3,3二乙基己烷的键线式为![]()
C.高聚物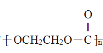 和
和![]() 均是缩聚产物,它们有共同的单体
均是缩聚产物,它们有共同的单体
D.将总物质的量为1 mol的水杨酸、1,2二氯乙烷和CH3NHCOOCH3的混合物与NaOH溶液充分反应,最多可以消耗2 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对有关微粒结构的表示或说法不正确的是( )
A.氮分子的电子式为::N:::N:
B.氨分子的空间构型为三角锥型,属于极性分子
C.白磷属于分子晶体,空间构型为正四面体,键角60°,是非极性分子
D.NH4+离子中的四个N—H键虽然形成方式不同,但键能、键长、键角都相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com