
| m |
| M |
| 46×0.2g |
| 2 |
| 46 |
| 62 |
| 4.6g+0.46g |
| 23g/mol |
| 8.8g |
| 100g |


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:

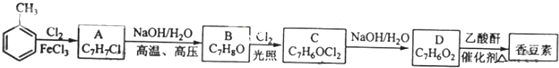
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、反应①的正反应是吸热反应 | ||
B、达平衡(Ⅰ)时,X的转化率为
| ||
| C、达平衡(Ⅰ)时体系的压强与反应开始时体系的压强之比为11:10 | ||
| D、在平衡(Ⅰ)和平衡(Ⅱ)中M的体积分数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知下列数据:
已知下列数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g?cm-3) |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | - | 338.0 | 1.84 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 测定中和热的实验装置如图所示.请回答下列问题:
测定中和热的实验装置如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

| A、电离平衡常数HA<HB |
| B、等体积的HA 和HB与等浓度的NaOH反应,HA消耗的NaOH多 |
| C、等体积的HA和HB 与Zn反应,HB反应速率大 |
| D、等浓度的NaA、NaB,碱性NaA>NaB |
查看答案和解析>>
科目:高中化学 来源: 题型:
 2006年是伟大的化学家、1954年诺贝尔化学奖得主、著名的化学结构大师、20世纪的科学怪杰鲍林(Linus Pauling)教授诞辰105周年(1901-1994).1994年这位世纪老人谢世,人们打开他的办公室,发现里面有一块黑板,画得满满的,其中一个结构式如右下图,老人为什么画这个结构式?它是生命前物质吗?它有什么性质?这是鲍林留给世人的一个谜,也许这是一个永远无法揭开的谜,也许你有朝一日能揭开它.不管结果如何,让我们对这个结构式作一番考察:
2006年是伟大的化学家、1954年诺贝尔化学奖得主、著名的化学结构大师、20世纪的科学怪杰鲍林(Linus Pauling)教授诞辰105周年(1901-1994).1994年这位世纪老人谢世,人们打开他的办公室,发现里面有一块黑板,画得满满的,其中一个结构式如右下图,老人为什么画这个结构式?它是生命前物质吗?它有什么性质?这是鲍林留给世人的一个谜,也许这是一个永远无法揭开的谜,也许你有朝一日能揭开它.不管结果如何,让我们对这个结构式作一番考察:查看答案和解析>>
科目:高中化学 来源: 题型:
 某有机物含碳、氢、氧、氮四种元素,其球棍模型如图所示,图中黑点表示原子,短线表示共价键.该有机物中的官能团有( )
某有机物含碳、氢、氧、氮四种元素,其球棍模型如图所示,图中黑点表示原子,短线表示共价键.该有机物中的官能团有( )| A、肽键、羟基 |
| B、羧基、肽键 |
| C、硝基、羟基 |
| D、醚键、肽键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com