
【题目】三氯化氧磷(POCl3)可用作有机合成的氯化剂和催化剂,实验室制取POCl3并测定产品含量的实验过程如下:

I.制备POCl3可用氧气氧化液态的PCl3法。实验装置(加热及夹持装置省略)及相关信息如下。
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其 他 |
PCl3 | -112.0 | 76.0 | 137.5 | 均为无色液体,遇水均剧烈水解为含氧酸和氯化氢,两者互溶 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1)装MnO2的仪器名称是__________;干燥管的作用为_________________________。
(2)装置B中的液体药品是_____;装置B有三个作用,分别为______________________。
(3)三氯化氧磷还可由三氯化磷与水、氯气反应制备。此方法生产三氯化氧磷的化学方程式为____________________________________。
II.测定POCl3产品含量的实验步骤:
①实验I结束后,待反应器中液体冷却到室温,准确称取一定质量的 POCl3产品(杂质不含氯元素),置于盛有100.00 mL蒸馏水的烧杯中摇动至完全水解,将水解液配成200.00 mL溶液
②取10.00 mL溶液于锥形瓶中,加入10.00 mL 1.5 mol/L AgNO3标准溶液
③加入少量硝基苯,用力摇动,静置
④加入指示剂,用0.2 mol/L KSCN溶液滴定过量的AgNO3溶液,到达终点时共用去15.00 mL KSCN溶液。
(4)选择的指示剂为___________。
(5)测得产品中n(POCl3)= ___________________________。(已知:磷酸银可溶于酸)
(6)已知Ksp(AgCl)> Ksp(AgSCN),步骤③的目的是________________________________。
【答案】 圆底烧瓶 防止空气中的水蒸气进入三颈烧瓶 浓硫酸 平衡气压、干燥氧气 、观察氧气流速 PCl3+H2O+Cl2=POCl3+2HCl 硫酸铁(合理即可) 0.08mol 由于AgSCN沉淀的溶解度比AgCl小,加入硝基苯用力摇动,使AgCl沉淀表面被有机物覆盖,避免在滴加KSCN时,将AgCl沉淀转化为AgSCN沉淀
【解析】I.A装置中用双氧水与二氧化锰反应生成氧气,通过加入双氧水的量,可以控制产生氧气的速率,氧气中含有水蒸气用浓硫酸除去,所以B装置中装浓硫酸,装置B中有上颈漏斗,可以平衡装置内外的压强,起安全瓶的作用,纯净的氧气与三氯化磷反应生成POCl3,为了控制反应速率且要防止三氯化磷会挥发,反应的温度控制在60~65℃,所以装置C中用水浴,为防止POCl3挥发,用冷凝管a进行冷凝回流,POCl3遇水均剧烈水解为含氧酸和氯化氢,所以为防止空气中水蒸汽进入装置,同时吸收尾气,所以在装置的最后连有碱石灰的干燥管。
(1)根据图示,装MnO2的仪器为圆底烧瓶;根据题意,PCl3遇水均剧烈水解为含氧酸和氯化氢,干燥管可以防止空气中的水蒸气进入三颈烧瓶,故答案为:圆底烧瓶;防止空气中的水蒸气进入三颈烧瓶;
(2)装置A中生成的氧气中含有水蒸气,PCl3遇水均剧烈水解为含氧酸和氯化氢,需用装置B中的液体干燥氧气,可以选用浓硫酸;装置B有三个作用,分别为平衡气压、干燥氧气 、观察氧气流速,故答案为:浓硫酸;平衡气压、干燥氧气 、观察氧气流速;
(3)三氯化氧磷还可由三氯化磷与水、氯气反应制备,反应的化学方程式为PCl3+H2O+Cl2=POCl3+2HCl,故答案为:PCl3+H2O+Cl2=POCl3+2HCl;
(4)铁离子遇到KSCN会显示红色,可以硫酸铁溶液为指示剂,用KSCN溶液滴定过量的AgNO3溶液达到终点时的现象是溶液变红色,故答案为:硫酸铁;
(5)KSCN的物质的量为0.2mol/L×0.015L=0.003mol,根据反应Ag++SCN-=AgSCN↓,可知溶液中剩余的银离子的物质的量为0.003mol,根据Ag++Cl-=AgCl↓,POCl3与水反应生成氯化氢的物质的量为1.5 mol/L×0.01L-0.003mol=0.012mol,则产品中POCl3的物质的量为0.012mol×![]() ×
×![]() =0.08mol,故答案为:0.08mol;
=0.08mol,故答案为:0.08mol;
(6)由于AgSCN沉淀的溶解度比AgCl小,加入硝基苯用力摇动,使AgCl沉淀表面被有机物覆盖,避免在滴加KSCN时,将AgCl沉淀转化为AgSCN沉淀,故答案为:由于AgSCN沉淀的溶解度比AgCl小,加入硝基苯用力摇动,使AgCl沉淀表面被有机物覆盖,避免在滴加KSCN时,将AgCl沉淀转化为AgSCN沉淀。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】C、N、O、S、H都是中学化学中常见的元素。按要求完成下列填空。
(1)0.5 mol CH4的质量为____________;标准状况下,4.48 L NH3所含分子数为___________。
(2)等物质的量的CH4、NH3和N2三种气体,所含原子数之比为__________,等质量的CH4和N2物质的量之比为__________。
(3)含有1.806×1024个电子的OH- 的物质的量为____;0.5 mol H2O分子中所含电子数与_____个NH4+中所含电子数相等。
(4)在标准状况下,由SO2和CO2组成的混合气体为8.96 L,质量为24 g,该混合气体的平均摩尔质量是__________,混合气体中CO2的体积分数是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有K+、Fe3+、NO3﹣ , 已知K+、Fe3+的个数分别为3a和a,则溶液中K+与NO3﹣的个数比为( )
A.1:4
B.1:2
C.3:4
D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用二氧化锰和浓盐酸共热的方法制取氯气。根据要求回答下列问题。
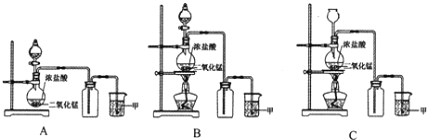
(1)A、B、C三套装置中,应选用的装置是____________(选填“A”、“B”、“C”);
(2)写出制取氯气的化学方程式_________________________________________。
(3)为了防止氯气污染环境,图中溶液甲中发生的化学反应方程式___________________。
(4)由于氯气贮存运输不方便,工业上常将氯气转化为漂白粉,工业上生产漂白粉的主要化学方程式是_____________________,在空气中漂白粉长期存放会变质而失效的原理是(用化学方程式说明) ___________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是生物体内四种有机物的组成与功能关系图,有关叙述错误的是
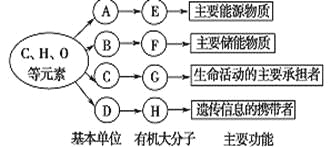
A. 小麦种子细胞中,物质A是葡萄糖,物质E是淀粉
B. 相同质量的E和F彻底氧化分解,释放能量较多的是F
C. 物质C的种类约有20种,基本组成元素是C、H、O、N
D. SARS病毒的物质H彻底水解后,产物是CO2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三聚氰胺污染牛奶事件社会影响极坏。向牛奶和奶粉中添加三聚氰胺,主要是因为它能冒充蛋白质。已知三聚氰胺中含有碳、氢、氮三种元素,其相对分子质量为126。为测定三聚氰胺的组成,用下列各仪器装置,在过量的氧气流中将2.52g三聚氰胺样品氧化成CO2、H2O和N2。回答下列问题:

(1)产生的氧气按从左向右的流向,所选装置各导管的连接顺序是g接_______、____接___、____接j、k接___、____接___。
(2)装置F中CuO的作用是__________________________________________________。
(3)实验前后称得A、B两装置的质量分别增加2.64g和1.08g,则三聚氰胺的分子式为_________________。
(4)按(1)的连接方法,此实验装置存在的缺点是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的原子最外层只有一个电子,其原子与卤素原子结合时,所形成的化学键( )
A.一定是离子键
B.一定是共价键
C.可能是离子键也可能是共价键
D.以上说法都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是铜锌原电池示意图,图2中,x轴表示实验时流入正极的电子的物质的量。下列说法不正确的是

A. 溶液中的SO42-向锌电极移动
B. 在锌电极上可观察到大量气泡产生
C. 电流由铜电极流向锌电极
D. 图2中y轴表示的可能是c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素R的最高价氧化物的水化物分子式是HnRO2n﹣2 , 则在气态氢化物中R元素的化合价是( )
A.3n﹣10
B.12﹣3n
C.3n﹣4
D.3n﹣12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com