
| A、与W相邻的同主族元素单质的重要用途是制作光纤 |
| B、X单质不可能置换出W单质 |
| C、元素原子半径从大到小的顺序是X、Y、Z |
| D、由非金属性强弱可知,不可能由W的含氧酸制备Z的含氧酸 |
| ||


科目:高中化学 来源: 题型:
| A、明矾[KAl(SO4)2?12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 |
| B、用蒸馏水充分浸润燃尽后的火柴头,然后加入硝酸银和稀硝酸检验火柴头中氯元素 |
| C、浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应 |
| D、用食醋和碘化钾淀粉试纸可以鉴别NaNO2和NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、H2O和D2O是同位素 |
| B、氢氧两种元素只能组成水 |
| C、水分子之间不只存在范德华力 |
| D、图中球棍模型也可表示CO2的结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| L/min | 0 | 2 | 4 | 6 | 8 | … | 16 | 18 |
| n(X)/mol | 1.600 | 1.200 | 1.100 | 1.075 | … | … | 1.000 | 1.000 |
| c2(Z) |
| c(X)?c(Y) |
查看答案和解析>>
科目:高中化学 来源: 题型:
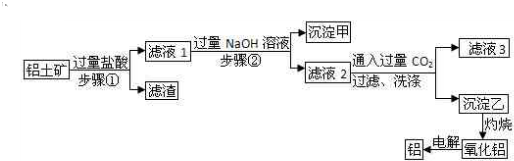
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| W | X | ||
| Y | Z |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 3-n |
| 2 |
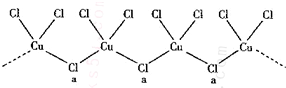
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com