
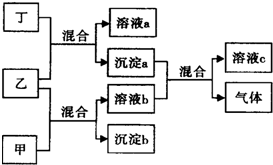
 现有四瓶贴有甲、乙、丙、丁标签的溶液,它们可能是K2CO3、Ba(NO3)2、NaHSO4和K2SO4溶液.现进行如下实验,并记录部分现象(如图):
现有四瓶贴有甲、乙、丙、丁标签的溶液,它们可能是K2CO3、Ba(NO3)2、NaHSO4和K2SO4溶液.现进行如下实验,并记录部分现象(如图):分析 甲、乙、丙、丁的溶液,它们可能是K2CO3、Ba(NO3)2、NaHSO4和K2SO4溶液,根据题中各物质转化关系,生成的沉淀a和b只能是BaCO3和BaSO4,所以乙中应含有Ba2+,由于沉淀a能和溶液b反应且生成气体,则沉淀a是BaCO3,溶液b中含有H+,据此可以确定乙为Ba(NO3)2,丁为K2CO3,甲为NaHSO4,则丙为K2SO4,据此可以书写离子方程式,可以利用盐酸和澄清的石灰水检验CO32-的存在,据此答题;
解答 解:甲、乙、丙、丁的溶液,它们可能是K2CO3、Ba(NO3)2、NaHSO4和K2SO4溶液,根据题中各物质转化关系,生成的沉淀a和b只能是BaCO3和BaSO4,所以乙中应含有Ba2+,由于沉淀a能和溶液b反应且生成气体,则沉淀a是BaCO3,溶液b中含有H+,据此可以确定乙为Ba(NO3)2,丁为K2CO3,甲为NaHSO4,则丙为K2SO4,据此可以书写离子方程式,可以利用盐酸和澄清的石灰水检验CO32-的存在,
(1)根据上面的分析可知,甲为NaHSO4,乙为Ba(NO3)2,丁为K2CO3,
故答案为:NaHSO4、Ba(NO3)2、K2CO3;
(2)甲+乙反应的离子方程式为:Ba2++SO42-=BaSO4↓,沉淀a+溶液b的离子方程式为:BaCO3+2H+=Ba2++CO2↑+H2O,
故答案为:Ba2++SO42-=BaSO4↓;BaCO3+2H+=Ba2++CO2↑+H2O;
(3)丙为K2SO4,检验物质D中阳离子的方法为用洁净的铂丝蘸取丙(或K2SO4)溶液少许,在煤气灯外焰灼烧,透过蓝色钴玻璃观察火焰颜色,若火焰颜色为紫色,则溶液中含有钾离子,
故答案为:用洁净的铂丝蘸取丙(或K2SO4)溶液少许,在煤气灯外焰灼烧,透过蓝色钴玻璃观察火焰颜色,若火焰颜色为紫色,则溶液中含有钾离子.
点评 本题考查溶液中物质之间的反应,注意根据反应的现象进行物质推断,再根据相关物质的性质解答,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)═c(HCO3-)+c(CO32-)+c(H2CO3) | |
| B. | c (Na+)+c (H+)═c (HCO3-)+c (CO32-)+c (OH-) | |
| C. | HCO3- 的电离程度大于HCO3-的水解程度 | |
| D. | c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酒精的燃烧热△H=(Q2-Q3-3Q1)kJ/mol | |
| B. | 由③可知1molC2H5OH(g)的能量大于2molCO2(g)和3molH2O(g)的总能量 | |
| C. | H2O(g)→H2O(l)释放出了热量,所以该过程为放热反应 | |
| D. | 23g液态酒精完全燃烧生成CO2(g)和H2O(l),放出的热量为(0.5Q2-0.5Q3-1.5Q1)kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol/L | |
| B. | 从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液中氢离子的浓度为2 mol/L | |
| C. | 配制480 mL 0.5 mol/L的CuSO4溶液,需称取62.5 g胆矾 | |
| D. | 中和100 mL 1mol/L的H2SO4溶液,需NaOH为4 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径比较:X<Y<Z<W | |
| B. | Y的氢化物沸点高于W的氢化物 | |
| C. | Y的氢化物稳定性一定弱于W的氢化物 | |
| D. | 短周期所有元素中,w的最高价氧化物的水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了使过滤速率加快,可用玻璃棒在过滤器中轻轻搅拌,加速液体流动 | |
| B. | 分液时,分液漏斗中的两层液体均从下口放出 | |
| C. | 为加速固体物质的溶解可采用研磨、振荡、搅拌、加热等方法 | |
| D. | 为增大气体物质的溶解度,常采用搅拌,加热等措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸除水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 向次氯酸钙溶液中通入少量SO2:Ca2++2ClO-+H2O+SO2═CaSO3↓+2HClO | |
| C. | 碘化亚铁溶液中通入少量氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 硝酸亚铁溶液中滴加稀硫酸:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一定条件下,反应X(g)+3Y(g)?2Z(g)△H=-92.4 kJ/mol,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
在一定条件下,反应X(g)+3Y(g)?2Z(g)△H=-92.4 kJ/mol,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )| A. | 图中A、B两点,达到相同的平衡体系 | |
| B. | 上述反应在达到平衡后,增大压强,H2的转化率提高 | |
| C. | 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小 | |
| D. | 将1.0 mol X、3.0 mol Y,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com