
 )的酸性废水,可利用微生物电池法除去,其原理如图2所示
)的酸性废水,可利用微生物电池法除去,其原理如图2所示 -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-
-OH+Cl-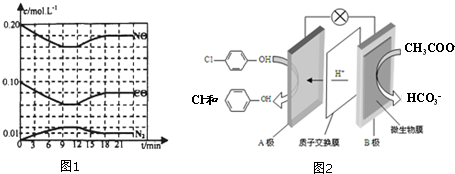
分析 (1)根据酸雨分为硫酸型酸雨和硝酸型酸雨来分析;
(2)根据盖斯定律来计算;
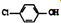
(3)①图象分析可知一氧化碳浓度变化为0.04mol/L,二氧化碳生成浓度为0.04mol/L,反应速率v=$\frac{△c}{△t}$计算;
②图象分析判断12min后反应物浓度增大,生成物浓度减小,说明平衡逆向进行,反应是放热反应,升温改变符合图象变化;
③依据图象读出平衡浓度,结合平衡常数概念计算平衡常数,再加入物质浓度,可以利用浓度商计算和平衡常数比较判断反应进行的方向;
(4)①根据原电池中阳离子的移动方向确定正负极;
②根据电解池的工作原理结合电极反应来回答判断;
③根据电极反应式结合电子得失守恒来计算.
解答 解:(1)酸雨分为硫酸型酸雨和硝酸型酸雨,形成硫酸型酸雨的原因是SO2的排放,硝酸型酸雨的形成是由于NO2的排放,大气污染物中,形成光化学烟雾的主要物质是NO2,
故答案为:NO2;
(2)已知:①N2(g)+O2(g)═2NO(g)△H═+180.5kJ•mol-1:
②2C(s)+O2(g)═2CO(g)△H═-221.0kJ•mol-1
③C(s)+O2(g)═CO2(g)△H═-393.5kJ•mol-1
由盖斯定律可知,将2×③-①-②可得:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=(-393.5kJ•mol-1)×2-(+180.5kJ•mol-1)-(-221.0kJ•mol-1)=-746.5KJ/mol
故答案为:-746.5KJ/mol;
(3)①反应从开始到9min时,图象分析可知一氧化碳浓度变化为0.04mol/L,二氧化碳生成浓度为0.04mol/L,用CO2表示该反应的速率=$\frac{0.04}{9}$mol/(L•min),
故答案为:$\frac{0.04}{9}$mol/(L•min);
②图象分析可知12min后一氧化氮和一氧化碳浓度增大,氮气浓度减小,说明平衡逆向进行,反应是放热反应,升温平衡逆向进行,符合图象变化,
故答案为:升温;
③依据图象分析,18min时平衡状态下物质的浓度为c(NO)=0.18mol/L,c(CO)=0.08mol/L,c(N2)=0.01mol/L,c(CO2)=0.02mol/L,反应的平衡常数依据平衡常数概念计算,2NO(g)+2CO(g)?N2(g)+2CO2(g),K=$\frac{{c}^{2}(C{O}_{2})c({N}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$=$\frac{0.0{2}^{2}×0.01}{0.1{8}^{2}×0.0{8}^{2}}$;若保持温度不变,此时再向容器中充入CO、NO各0.060mol,浓度商计算Qc=$\frac{0.0{2}^{2}×0.07}{0.1{8}^{2}×0.1{4}^{2}}$=0.044>K,平衡逆向进行,
故答案为:$\frac{0.0{2}^{2}×0.01}{0.1{8}^{2}×0.0{8}^{2}}$;逆向;
(4)①原电池中氢离子的移动方向是从负极流向正极,所以B是电池的负极,
故答案为:负;
②A是正极,正极上发生得电子的还原反应:Cl- -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-,
-OH+Cl-,
故答案为:Cl- -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-;
-OH+Cl-;
③由图2可知,A极即正极反应为:Cl- -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-,A极区溶液体积为1L,pH从4变到1,故△n(H+)=0.1mol,则知A极得0.2mol电子,根据正负极得失电子数相等可知,负极失去的电子数也为0.2mol,根据负极反应:CH3COO--8e-+2H2O=2CO2+7H+,可知,处理掉的乙酸钠的物质的量为$\frac{0.2}{8}$mol,故质量为:$\frac{0.2}{8}$×82g/mol=2.05g.
-OH+Cl-,A极区溶液体积为1L,pH从4变到1,故△n(H+)=0.1mol,则知A极得0.2mol电子,根据正负极得失电子数相等可知,负极失去的电子数也为0.2mol,根据负极反应:CH3COO--8e-+2H2O=2CO2+7H+,可知,处理掉的乙酸钠的物质的量为$\frac{0.2}{8}$mol,故质量为:$\frac{0.2}{8}$×82g/mol=2.05g.
故答案为:2.05g.
点评 本题涉及电解池和原电池的工作原理以及应用的考查,注意知识的迁移和应用是解题的关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 水属于氧化物 | B. | 水分子中含有非极性键 | ||
| C. | 冰与可燃冰的化学成分完全相同 | D. | 氟气与水的反应中,水作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
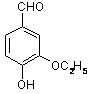 是食品添加剂的增香原料,其香味比香草醛更浓郁.
是食品添加剂的增香原料,其香味比香草醛更浓郁.
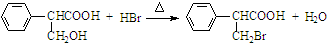 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型).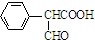 .
.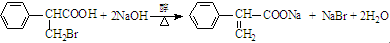 .
.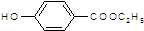 )是一种医药中间体,请设计合理方案用
)是一种医药中间体,请设计合理方案用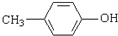 合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).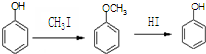
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的CHCl3含有的分子数为0.5NA | |
| B. | 28gSi晶体中含有Si-Si键的个数为4NA | |
| C. | 常温下,78g某浓度的乙炔的苯溶液中含碳原子数为6NA | |
| D. | 0.1 molCnH2n+2中含有的碳碳单键数为0.1nNA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g CO、C2H4混合气体的分子总数NA,体积约为22.4L | |
| B. | 9.2g金属钠投入到足量的重水中所得气体中含有0.4NA中子 | |
| C. | 25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| D. | 0.1mol/LFeCl3溶液中所含Fe3+的数目小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z | |
| 原子半径/nm | 0.154 | 0.130 | 0.071 |
| A. | 原子最外层电子数:Z>X>Y | B. | 三种元素可能为同周期元素 | ||
| C. | 原子序数:Y>X>Z | D. | 离子半径:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
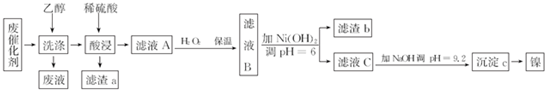
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
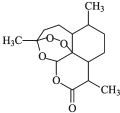 2015年,中国科学家屠呦呦因发现治疗疟疾的药物青蒿素获得了诺贝尔奖.青蒿素的结构如图所示,下列有关青蒿素的说法中正确的是( )
2015年,中国科学家屠呦呦因发现治疗疟疾的药物青蒿素获得了诺贝尔奖.青蒿素的结构如图所示,下列有关青蒿素的说法中正确的是( )| A. | 分子式为C15H20O5 | B. | 具有较强的还原性 | ||
| C. | 易溶于水,乙醇和乙醚 | D. | 氧原子的化合价由-1和-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com